下图为铜丝与浓硫酸反应并验证其产物性质的实验装置。

(1)①中反应的化学方程式是_________________________。
(2)②中饱和NaHSO3溶液的作用是除去__________。加热一段时间后,③中溶液依然澄清,想要立即终止铜与硫酸的反应,最恰当的方法是___________。
a.上移铜丝,使其脱离硫酸 b.撤去酒精灯 c.拔去橡胶塞倒出硫酸
(3)反应停止后,待装置冷却,把③取下后将其中溶液分成两份做如下实验:
| |
加入试剂 |
现象 |
反应的离子方程式 |
| 第一份 |
加入NaOH溶液 |
有白色沉淀生成 |
_______________ |
| 第二份 |
加入氯水 |
有白色沉淀生成 |
_______________ |
完成上述反应的离子方程式。
(4)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色。取少量蓝色溶液于试管中,滴加NaOH溶液过量,出现的现象是_________________。
用下图装置可证明CO2与NaOH溶液发生了反应:
(1)将A与B连接,打开止水夹将胶头滴管中的液体挤入烧瓶,此时的现象是,反应的离子方程式_______。
(2)向100 mL2 mol/L的NaOH 溶液中通入一定量CO2,充分反应后,将溶液蒸发结晶,得到少量白色固体,请设计实验确认该固体的成分:
①提出合理假设:
假设1:该固体为NaOH和Na2CO3; 假设2:该固体只有Na2CO3;
假设2:该固体只有Na2CO3;
假设3:该固体只有。
假设4:该固体为____________。
②.请设计实验验证假设1的固体是NaOH和Na2CO3,写出步骤及预期的现象和结论。(步骤可不填满也可增加)
限选的试剂、仪器: 1moL·L–1HCl、1mol·L–1 MgCl2、0.5moL·L–1BaCl2和1mol·L–1 Ba(OH)2溶液,甲基橙、酚酞试液,试管、胶头滴管、过滤装置。
| 实验步骤 |
预期现象和结论 |
| 步骤1: |
|
| 步骤2: |
|
| 步骤3: |
医用氯化钙可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2 ·2H2O的质量分数为97.3—103.0%),工艺流程为:
(可能用到的原子量:Cl 35.5 Ca40 O 16 )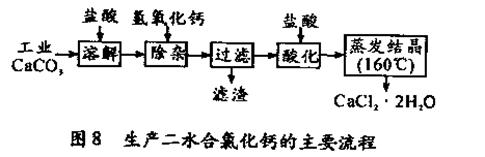
(1)CaCO3与盐酸反应的离子方程式。
(2)过滤时需用的玻璃仪器除烧杯、玻璃棒外还有。滤渣主要成分的化学式。
(3)酸化时加盐酸的目的为:
①,
②防止Ca2+ 在蒸发时发生水解。
(4)为什么蒸发结晶要保持在160℃: 。
。
(5)为测定样品中CaCl2 ·2H2O的含量,称取0.7522g样品并配成250mL溶液,分别取该溶液25.00mL于三个锥形瓶中,用0.04mol/LAgNO3溶液进行三次滴定,消耗 AgNO3溶液的平均体积为20.39mL。
①通过计算,样品中含CaCl2 ·2H2O的质量分数。(只写计算式不计算结果)。
②若所测样品 CaCl2 ·2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为 。
。
(16分) 图Ⅰ是实验室中常用于制备和干燥气体的装置: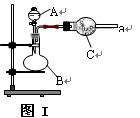
(1)甲同学用图Ⅰ装置、铜和浓硝酸制备并收集干燥的NO2气体:
① B中反应的化学方程式__________ ___________________。
___________________。
② 收集NO2气体的方法;
③ 将收集满NO2的烧瓶密封浸入冰水中,烧瓶内气体颜色变浅,则下列反应:
2NO2 (g)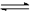 N2O4(g)ΔH 中的ΔH0(填“>”或“<”)
N2O4(g)ΔH 中的ΔH0(填“>”或“<”)
(2) 乙同学用图Ⅰ装置制取NH3和O2的混合气体,用图Ⅱ装置验证氨的某些性质:
往A中加入浓氨水,B中加入Na2O2固体,C中加入碱石灰,D内放置催化剂(铂石棉),按气流方向a→ b→c→ h连接各仪器 :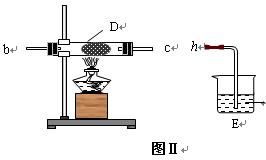
① 实验中观察到D内有红棕色气体出现,证明氨气具有____(填“氧化性”或“还原性”)。
② D中反应的化学方程式为_____________________、.
③为防止NO2 污染环境,E装置中装的试剂可以是。
有人设计一个Na 2O 2与CO 2反应实验装置图如下: 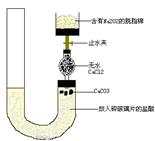
打开止水夹,发现CO 2通过裹有Na 2O 2的脱脂棉,可观察到脱脂棉剧烈燃烧起来.
(1)由实验现象所得出的有关Na 2O 2与CO 2反应的结论是:
a:有氧气生成:b:
(2)甲、乙两位同学各称取质量为m g的过氧化钠与二氧化碳反应后的样品,并用下图所示仪器测定样品的组分。 
请回答下列问题:
①甲同学通过实验测得的数据是氧气的体积,该同学读取实验数据时应注意冷却至室温、____________、眼睛视线与凹液面最低处相切。
②乙同学通过连接仪器①②进行实验,他测得的数据是 。按他测得的数据计算出的实验结果偏高,理由是 。
③为了测得准确的实验数据,请你将乙同学的实验装置进行改进(每种仪器只准使用一次),写出各仪器接口  的连接顺序 。k+s-5#u
的连接顺序 。k+s-5#u
④按③设计的实验装置进行实验,若测得实验前后装置②的质量分别是w 1g和w 2g,则样品中碳酸钠的质量分数为 。
⑤在③的改进装置中由于受到仪器的局限,是否也有不足之处 (若没有,此空不必回答;若有,请一并说出不足的理由)  。
。
纯碱、烧碱等是重要的化工原料。
(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是 。若其它操作不变,将A与C连接,可观察到的现象是 。 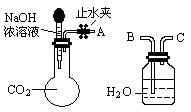
(2)向100 mL2 mol/L的NaOH 溶液中通入一定量CO 2,结晶,得到9.3 g白色固体,该白色固体的组成是 (写化学式)。
设计实验确认该白色固体中存在的阴离子,试完成下列方案。
| 实验操作 |
实验现象 |
结论 |
|
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl 2溶液 |
|||
| ②过滤,取2 mL滤液于试管中 |
|||
| ③ |
|||
(3)现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下: 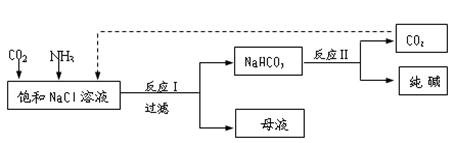 k+s-5#u
k+s-5#u
已知NaHCO 3在低温下溶解度较小。反应I为:
NaCl+CO 2+NH 3+H 2O  NaHCO 3↓+NH 4Cl,处理母液的两种方法如下。
NaHCO 3↓+NH 4Cl,处理母液的两种方法如下。
①向母液中加入石灰乳,可将其中 循环利用,同时得到融雪剂 。
②向母液中通入NH 3,加入细小的食盐颗粒并降温,可得到NH 4Cl晶体。
试写出通入NH 3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式:_______________________________________。