工业上为了处理含有Cr2O72-的酸性工业废水,采用下面的处理方法:往工业废水中加入适量的NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准。请回答下列问题。
(1)两极发生的电极反应式:阴极:_______________阳极:______________________
(2)写出Cr2O72-变为Cr3+的离子方程______________________________________。
(3)工业废水由酸性变为碱性的原因_______________________________________。
(4)________(填“能”或“不能”)改用石墨电极
有下列物质:①CO2②N2③H2O2④NH3⑤Ca(OH)2⑥Na2O2⑦NH4Cl,试用以上物质的序号填空:
(1)既有极性键,又有非极性键的是______________;
(2)既有离子键,又有非极性键的是______________;
(3)属于共价化合物的是______________。
某兴趣小组的同学用如图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。当乙池中C极质量减轻10.8 g时,回答下列问题。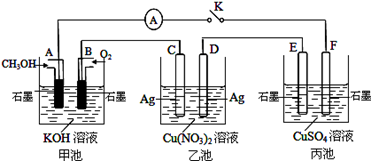
(1)写出A极的电极方程式:。
(2)甲池中B电极理论上消耗O2的体积(标准状况下)为多少毫升?
(3)若丙池中溶液的体积为1000 mL,此时丙池中溶液的pH为多少?
根据下列有机物转化流程回答: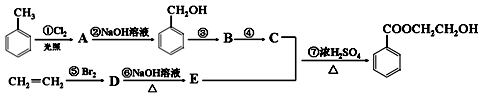
(1)写出A的结构简式: 。
(2)属于取代反应的有(填序号):。属于加成反应的有(填序号):。
(3)写出第①步反应的化学方程式:
____________________________________________________________________________
写出物质B与新制Cu(OH)2溶液反应的化学方程式:
___________________________________________________________________________
写出第⑥步反应的化学方程式:
___________________________________________________________________________
请根据所学化学知识回答下列问题:
(1)在浓度均为0.1 mol/L ①CH3COONH4、②NH4HSO4、③NH3·H2O、④(NH4)2SO4溶液中,NH4+浓度由大到小的顺序为(填序号)。
(2)氯化铝溶液蒸干,灼烧得到的固体物质是_________,用化学方程式说明其原因:
(3)某温度时蒸馏水的pH=6。将2.3 g金属钠放入该蒸馏水中,充分反应后再加该蒸馏水稀释到1 L,恢复到原温度时所得溶液的pH=。
已知某有机物的结构简式为: 。
。
(1)该有机物中所含官能团的名称是。
(2)该有机物发生加成聚合反应后,所得产物的结构简式为;
(3)写出该有机物发生消去反应的化学方程式(注明反应条件):
___________________________________________________________________________