空气质量高低直接影响着人类的生产和生活,它越来越受到人们的关注。被污染的空气中杂质的成分有多种,其中计入《空气质量日报》空气污染指数的项目有SO2、CO、NO2、O3和可吸入颗粒物等。
请回答下列问题:
⑴ S、N、O的第一电离能由大到小的顺序为 。
⑵血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒
①写出亚铁离子的基态电子排布式 。
② CO有多种等电子体,其中常见的两种为 。CO结构中σ键和П键数目之比为 
③Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ___________ (填晶体类型),Fe元素的化合价 。
⑶SO2是一种大气污染物,为减轻SO2污染,火力发电厂生产中常在燃煤中加入CaO以“固硫”。 CaO晶胞如图所示,其中Ca2+周围的阴离子配位数为 ,CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO:3401kJ/mol、NaCl:786kJ/mol。CaO晶体的熔点 NaCl晶体的熔点(填“高于”、“等于”或“低于”),导致两者晶格能差异的主要原因是 。

⑷随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和食品安全也越来越为人们所关注。甲醛是室内主要空气污染物之一(其沸点是-19.5 ℃),甲醇是“假酒”中的主要有害物质(其沸点是64.65 ℃),甲醇的沸点明显高于甲醛的主要原因是: 。
A、B、C、D四种短周期元素。原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体甲;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)写出下列元素的名称:A_______,B,C_______,D。
(2)D的质子数和中子数相等,D的原子组成符号为,它的最高价为_________价。
(3)用电子式表示A、B两元素形成AB2的过:;
写出C2B2的电子式。
(4)氢元素与B、D 均可以形成原子个数比为2:1的化合物,H2B的熔沸点高于H2D的原因是。
(5)写出甲和A的最高价氧化物反应的化学方式:。
某气态烷烃A的密度是相同状况下H2的29倍,则:A的分子式为,请写出A所有同分异构体的结构简式,其一氯取代产物共有种。
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式: _______________________________
(2)若将(1)中的反应设计成原电池,请在方框内画出原电池的装置图,标出正、负极及材料、电解质溶液并写出电极反应式。 
正极反应____________________________;
负极反应____________________________。
(3)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答下列问题: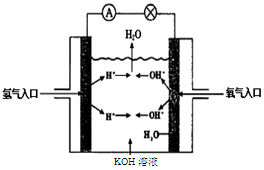
①负极反应式为溶液PH(填“增大”、“不变”或“减小”)。
②该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2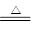 2LiHⅡ.LiH+H2O=LiOH+H2↑
2LiHⅡ.LiH+H2O=LiOH+H2↑
反应Ⅰ中的还原剂是,7 gLi可吸收标况下H2L,此时转移电子moL。
完成下列方程式(要注明反应条件)。
①甲烷与氯气反应制一氯甲烷:________________________②乙烯使溴水褪色:_______________
③苯和液溴混合加铁粉 :__________________④制备乙酸乙酯:_________________________________
有下列几组物质或微粒:
| A.11H和21H | B.甲烷和乙烷 | C.红磷和白磷 | D.金刚石、石墨和C60 |
E.丁烷和异丁烷F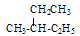 和
和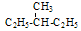 其中,属于同分异构体的是______;属于同位素的是______;属于同素异形体的是_______;属于同一种物质的是________;属于同系物的是_________。(填字母编号)
其中,属于同分异构体的是______;属于同位素的是______;属于同素异形体的是_______;属于同一种物质的是________;属于同系物的是_________。(填字母编号)