(8分)亚氯酸钠(NaClO2)是一种重要的消毒剂。已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O,②ClO2的沸点为283K,纯ClO2易分解爆炸,③HClO2在25℃时的电离程度与硫酸的第二步电离程度相当,可视为强酸。如图是过氧化氢法生产亚氯酸钠的工艺流程图: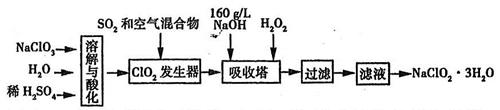
(1)C1O2发生器中所发生反应的离子方程式为 ,发生器中鼓入空气的作用可能是 (选填序号)。
A.将SO2氧化成SO3增强酸性
B.稀释C1O2以防止爆炸
C.将NaClO3氧化成C1O2
(2)在该实验中用质量浓度来表示NaOH溶液的组成,若实验时需要450mLl60g/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是 g,所使用的仪器除托盘天平、量筒、烧杯、玻璃棒外,还必须有
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量所需要的试剂是
(4)在吸收塔中,可代替H2O2的试剂是 (填序号)。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(5)从滤液中得到NaClO2·3H2O晶体的实验操作依次是 (填操作名称)
(10分) (1)将一小块金属钠投入水中,发生反应的化学方程式为,请回答:可观察到的实验现象是_____________(填字母)。
a.钠沉到水底
b.钠熔成小球
c.小球四处游动
d.向反应后的溶液中滴加酚酞试剂,溶液变为红色
(2)在实验室中,通常将金属钠保存在(填字母)。
a.水中 b.煤油中 c.四氯化碳中
(3)过氧化钠与水反应,化学方程式:。
(4)过氧化钠与二氧化碳反应,化学方程式:。
回答下列关于铁元素及其化合物的知识:
(1)除去铁粉中混有的铝粉可以选用的试剂为(填序号)。
A.稀盐酸 B.氢氧化钠溶液 C.浓硫酸
(2)在常温下,铁与水并不起反应,但在高温下,铁与水蒸气可发生反应。
该反应的化学方程式;
该反应中的还原剂是,氧化剂是。
(3)实验室在保存FeCl2溶液时为了防止FeCl2溶液变质,经常向其中加入铁粉,其原因是(用离子方程式表示)。
(1)SO2的摩尔质量为,1molSO2中含有氧原子的个数为,标况下5.6LSO2的质量为。
(2)用20g烧碱配制成500mL溶液,其物质的量浓度为mol/L;从中取出1mL,其物质的量浓度为mol/L;若将这1mL溶液用水稀释到100mL,所得溶液中溶质的物质的量浓度为mol/L。
有铜片、锌片、若干小烧杯、导线、、盐桥(含琼胶的KCl饱和溶液)、电流计、ZnSO4溶液、CuSO4溶液,试画出原电池的装置图,并说明其工作原理。
⑴原电池装置图;⑵工作原理;
有A、B、C、D、E、Q六种元素,它们的核电荷数依次增大,A是元素周期表中原子半径最小的一种元素,B、C、D、E均比A多一个电子层,且B、C、D、E是连继相邻的四种元素,其中E是元素周期表中非金属性最强的一种元素,Q的核电荷数是A、B、D、E的核电荷数的总和,按要求完成下列问题:
⑴.这几种元素中电负性最大的是()(填元素符号,下同);
⑵.B、C、D、E的第一电离能由小到大的顺序是(),原子半径由大到小的顺序是();
⑶.C的氢化物的电子式是(),C的氢化物结构式是(),C的最高价氧化物对应的水化物的化学式是(),C的最高价氧化物对应的水化物和C的最低价氢物形成的化合物的化学式是();
⑷.Q的电子排布式是(),Q的价电子排布式是(),Q的价电子排布图是()。
⑸.说出D、Q在周期表中的分区,D在()区,Q在()区, D原子核外有()个成单电子.
⑹.元素B在周期表中位于第()周期,第()族。