(1)肼(N2H4)又称联氨,是一种可燃性液体,可用作火箭燃料。已知在101kPa,320g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧的热化学方程式是:
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液。肼—空气燃料电池放电时,正极的电极反应式是 ;负极的电极反应式是 。
(3)如图是一个电化学过程示意图。假设使用肼—空气燃料电池作为本过程的电源,铜片质量变化128g,则肼—空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气的体积含量为20%)。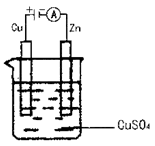
(4)传统制备肼的方法是以NaClO氧化NH3制得肼的稀溶液,该反应的离子方程式是 。
a、b、c、d、e、f、g为七种由短期周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 |
a |
b |
c |
d |
e |
f |
g |
| 原子核数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
| 单位电荷数 |
0 |
1+ |
1- |
0 |
2+ |
1+ |
0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可反应生成两个共价型g分子。试写出:
(1)d分子的空间构型为。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:>(用化学式表示)。
(3)d溶于水的电离方程式。
(4)g粒子所构成的晶体类型属。
(5)c粒子是,f粒子是(都用化学式表示)。
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: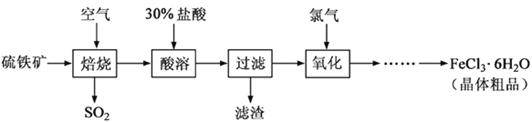
回答下列问题:
(1)硫铁矿高温焙烧的化学方程式为;少量的SO2与NaOH溶液反应的离子方程式为。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率和,
题问所涉及反应的离子方程式为。
(3)通氯气氧化时,发生的主要反应的离子方程式为;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为(写化学式)。
A是一种无色透明的晶体,进行如下实验:
①取少量A晶体做焰色反应实验,透过蓝色钴玻璃观察,火焰呈紫色。
②取少量A晶体溶于水可以得到无色的溶液,该溶液使石蕊变红。
③取少量A的溶液加过量氨水,有白色沉淀B生成。
④过滤除去③中的B后,在滤液中滴加氯化钡溶液,有白色沉淀C生成,C不溶于稀硝酸。
⑤取少量B滴加氢氧化钠溶液,得无色溶液D。
⑥取少量B滴加盐酸,得无色溶液E。
⑦将47.4 gA晶体在120 ℃下加热脱水,剩余物的质量为25.8 g。
根据上述实验现象和结果确定A、B、C、D、E,写出它们的化学式。
A:, B:, C:,
D:, E:。
(1)室温下,在pH=12的某种溶液中,由水电离的c(OH-)为。
(2)等体积的下列溶液中,阳离子的总物质的量最大的是。
①0.2 mol·L-1的CuSO4溶液②0.1 mol·L-1的Na2CO3
③0.2 mol·L-1的KCl④0.1 mol·L-1的Na2SO4
(3)浓度为0.100 mol·L-1的下列各物质的溶液中,c(NH4+)由大到小的顺序是。
①NH4Cl②NH4HSO4③NH3·H2O④CH3COONH4
自20世纪90年代以来,芳炔类大环化合物的研究发展十分迅速,具有不同分子结构和几何形状的这一类物质在高科技领域有着十分广泛的应用前景。合成芳炔类大环的一种方法是以苯乙炔(结构简式CH≡C- ,可以简写为≡-
,可以简写为≡- )为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
)为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
(1)上述系列中第1种物质的分子式为
(2)已知上述系列第1至第4种物质的分子直径在1~100nm之间,分别将它们溶解于有机溶剂中,形成的分散系为
(3)仔细分析以苯乙炔为基本原料,经过一定反应而得到最终产物时苯乙炔组成上的变化。假设反应过程中原料无损失,理论上消耗苯乙炔与所得芳炔类大环化合物的质量比为
(4)已知:以乙醇做溶剂CH2Br-CH2Br(1,2-二溴乙烷)与NaOH加热可以反应生成CH≡CH和NaBr等,该反应化学上称为消去反应。写出其方程式:
在实验中,制备上述系列化合物的原料苯乙炔可用苯乙烯(CH2=CH- )与Br2为主要起始物质,通过加成、消去两步反应制得。写出由苯乙烯制取苯乙炔的两步化学方程式(其他试剂自选)。
)与Br2为主要起始物质,通过加成、消去两步反应制得。写出由苯乙烯制取苯乙炔的两步化学方程式(其他试剂自选)。