为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入0.5mol/L Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究。已知:
| 水解反应 |
平衡常数(K) |
Fe3+ + 3H2O  Fe(OH)3 + 3H+ Fe(OH)3 + 3H+ |
7.9 × 10-4 |
Fe2+ + 2H2O  Fe(OH)2 + 2H+ Fe(OH)2 + 2H+ |
3.2 × 10-10 |
Cu2+ + 2H2O  Cu(OH)2 + 2H+ Cu(OH)2 + 2H+ |
3.2 × 10-7 |
请回答:(1)稀硝酸和Cu反应的化学方程式为 。
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计。
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、硝酸钠溶液、稀盐酸。
方案: 。
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下。
| 实验内容 |
实验现象 |
| 甲同学的实验方案 |
溶液逐渐变成蓝绿色, pH略有上升 |
| 乙同学的实验方案 |
无明显现象,pH没有明显变化。 |
①据实验现象写出发生反应的离子方程式: 。
②导致实验过程中溶液pH略有上升的可能原因是 。
③解释乙同学的实验现象 。
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的: 。
(6分)下列实验操作,最终得到的固体物质为 (填化学式)
(1)将K2CO3溶液蒸干____________________________
(2)将Na2SO3溶液蒸干___________________________
(3)将AlCl3溶液蒸干并灼烧_______________________
(10分)今有①CH3COOH ②HCl ③H2SO4三种溶液。根据要求回答下列问题:
(1)当它们pH相同时,其物质的量浓度由大到小排列是________________(填序号)
(2)当它们的物质的量浓度相同时,其pH由大到小的顺序是______________(填序号)
(3)中和等量的同一烧碱溶液,需相同的物质的量浓度的①②③三种酸溶液的体积比为
___________________________________。
(4)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为_____________________;此时所得到的三种溶液的pH大小关系为______________________。
[化学 选修5-有机化学基础] (共14分)有机化合物A、B、C、D完全燃烧均只生成CO2和H2O,且四种物质含碳质量分数均为40%,含氢质量分数均约6.7% 。又知:
①A常温、常压下呈气态,A、C都能发生银镜反应,但都不能发生水解反应;
②B和C互为同分异构体,l mol B完全燃烧需耗3mol氧气。核磁共振氢谱表明,B分子有四个吸收峰,且峰面积之比为3:1:1:1,B在浓硫酸存在下加热可生成W(C6H8O4,含有一个六元环);
③ RCOOH在一定条件下可被还原为RCHO,以下是由B制取C的一种合成路线(反应条件及副产物已略去):
试回答:
(1)A含有的官能团名称为
(2)B的结构简式为。反应B→X的化学方程式为。
(3)C与新制的Cu(OH)2反应的化学方程式。
(4)与B互为同分异构体,属于有机酸的酯类且含有羟基的化合物有多种,写出其中一种的结构简式:。
(5)写出Z→C的化学反应方程式:。
(6)若MD =" 6" MA,D是只含有一种官能团且碳原子的化学环境相同的六元环状物,又名肌醇。医学上将肌醇用于动脉硬化、高血脂症、脂肪肝的防治。则D的结构简式为 。
(每空2分,共14分)一化学兴趣小组的同学们对SO2与漂粉精的反应进行实验探究:
| 操作 |
现象 |
| 取4g漂粉精固体,加入100mL水 |
部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH |
pH试纸先变蓝(约为12),后褪色 |
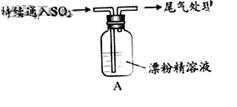 |
1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)C12和Ca(OH)2制取漂粉精的反应中氧化剂与还原剂的物质的量之比为。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是。
(3)向水中持续通入SO2,未观察到白雾。推测现象1的白雾由HC1小液滴形成。
①HC1的电子式是。
②兴趣小组将A中产生的白雾引出导入硝酸酸化的硝酸银溶液中,结果有沉淀产生,有同学据此判断白雾确为HC1小液滴,试评价该结论的合理性并说明理由。
(4)现象2中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HCl,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是。
②用离子方程式解释现象3中黄绿色褪去的原因:。
(每空2分,14分)硫酸有着重要的用途,硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计了以下实验方案,将硫酸废渣中金属元素转化为氢氧化物沉淀分离开来。
已知常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 |
Fe3+ |
Al3+ |
Mg2+ |
| 开始沉淀时的pH |
1.9 |
3.7 |
9.6 |
| 沉淀完全时的pH |
3.2 |
5.2 |
11.0 |
(1)固体A溶于NaOH溶液的化学方程式为_____________________________________。
(2)实验室用11.9mol/L的浓盐酸配制250mL3.0mol/L的稀盐酸,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要_______________________________________________。
(3)上述流程中的试剂Y最好选用下列中的 (选填字母编号)。
A.水 B.氧化镁 C.氨水 D.氢氧化钠
(4)写出溶液D中的金属离子在加入试剂Y时发生反应的离子方程式;
。
(5)实验室可用大理石和稀盐酸反应制取上述流程中所需的CO2,所用仪器如下,装置A产生CO2,按气流方向连接各仪器接口,顺序为a→ ,装置C中应盛放的试剂为 。