已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,但存在沉淀溶解平衡。当达到平衡时,溶液中离子浓度的乘积是一个常数(此常数用Ksp表示,Ksp和水的Kw相似)。
如:AgX(s) Ag+(aq)+X-(aq)
Ag+(aq)+X-(aq)
Ksp(AgX)===c(Ag+)·c(X-)=1.8×10-10
AgY(s) Ag+(aq)+Y-(aq)
Ag+(aq)+Y-(aq)
Ksp(AgY)===c(Ag+)·c(Y-)=1.0×10-12
AgZ(s) Ag+(aq)+Z-(aq)
Ag+(aq)+Z-(aq)
Ksp(AgZ)=c(Ag+)·c(Z-)=8.7×10-17
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(用已被溶解的溶质的物质的量/1 L溶液表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为________________________________________________________________________。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)________(填“增大”、“减小”或“不变”)。
(3)在25℃时,若取0.188 g的AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为________。
(4)①由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化?________,并简述理由:_________________________________________________________。
②在上述(3)体系中,能否实现AgY向AgX的转化?________,根据你的观点选答一项。
若不能,请简述理由:________________________________________________。
若能,则实现转化的必要条件是_________________________________________。
Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
| MnO2 |
触摸试管情况 |
观察结果 |
反应完成所需的时间 |
| 粉末状 |
很烫 |
剧烈反应,带火星的木条复燃 |
3.5min |
| 块状 |
微热 |
反应较慢,火星红亮但木条未复燃 |
30min |
(1)写出上述实验中发生反应的化学方程式:,该反应是反应(填放热或吸热)。
(2)实验结果表明,催化剂的催化效果与有关。
Ⅱ.某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如右图所示,图中数据分析: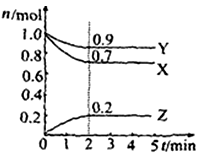
(1)该反应的化学方程式为:。
(2)反应开始至2min,用Z表示的平均反应速率为:。
(3)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g) + Y(g) = 2Z(g),当改变下列条件时,反应速率会减小
A.降低温度B.加入催化剂C.增大容器体积
如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL1.0mol/L。
(1)A为池,(填原电池、或电解池),其中的Ag极为极,发生反应(填“氧化”或“还原”)。
(2)B装置中的电极b极为极,电极反应式为,总反应的化学方程式为。经过一段时间后,B装置中溶液的碱性(填“增强”、“减弱”或“不变”)
(3)若工作一段时间后,当Zn片质量减少3.25g时,a极逸出的气体在标准状况下的体积为L。
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
(1)在这些元素中,化学性质最不活泼的是:(填具体化学用语,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是,碱性最强的化合物的电子式是:。
(3)最高价氧化物是两性氧化物的元素是;写出它的氧化物与氢氧化钠反应的离子方程式。
(4)②氢化物与③的单质在一定条件下反应的化学方程式为:。
(5) ②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因。
(6) 用结构式表示元素①与③形成的化合物 ,该化合物在固体时俗称,属于晶体,指出它的一种用途。
利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池。已知:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1、CH3OH(l)+ 3/2O2(g)= CO2 (g)+ 2H2O(l)ΔH=-726.5 kJ·mol-1、CO(g) +1/2O2(g)= CO2 (g)ΔH=-283.0 kJ·mol-1。
请回答下列问题:
⑴用太阳能分解18g水,需要消耗的能量为kJ。
⑵ 液态CH3OH不完全燃烧生成CO和液态H2O的热化学方程式为。
⑶CO2合成燃料CH3OH是碳减排的新方向。在容积为2 L的密闭容器中,充2 mol CO2和6 mol H2,由CO2和H2合成甲醇,反应式:CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):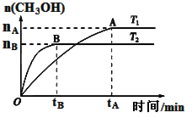
①下列说法正确的是
A.温度为T2时,从反应开始到平衡,生成甲醇的平均速率为: v(CH3OH)=nB/tBmol·(L·min)-1
B.T2>T1,T2平衡时,甲醇产量变少,所以该反应为放热反应
C.该反应在T2时的平衡常数比T1时的平衡常数大
D.处于A点的反应体系从T1变到T2,平衡逆向移动
②能判断该反应已达化学反应限度标志的是(填字母。
A.H2的百分含量保持不变
B.容器中CO2 浓度与H2浓度之比为1: 3
C.容器中混合气体的密度保持不变
D.CO2消耗速率与CH3OH生成速率相等
⑷科学家致力于CO2的“组合转化”技术研究,如将CO2和H2以体积比1∶4比例混合通入反应器,适当条件下,反应可获得一种能源。完成以下化学方程式,就能知道该种能源。
CO2+4H2 2H2O + 。
2H2O + 。
⑸ 在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,总反应式为:2CH3OH + 3O2=2CO2+4H2O,则正极的反应式为;负极的反应式为。
已知可逆反应CO2(g) + H2(g) CO(g) + H2O(g),
CO(g) + H2O(g),
⑴写出该反应的化学平衡常数表达式:K=。
⑵830K时,若起始时:c (CO2)=2mol/L,c (H2)=3mol/L,平衡时CO2的转化率为60%,氢气的转化率为;K值为。
⑶830K时,若只将起始时c (H2)改为6mol/L,则氢气的转化率为。
⑷若830K时,起始浓度c (CO2) =" a" mol/L,c (H2) =" b" mol/L,H2O的平衡浓度为c (H2O) =" c" mol/L,则:①a、b、c之间的关系式是 ;②当a = b时,a =c。