(共13分)A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与L分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上八种元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式)____________,E、F、L所形成的简单离子的半径由大到小的顺序为(用离子符号表示)__ __ > > 。
(2)由L、I两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为 。固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为: 。
(3)在10 L的密闭容器中,通入2mol LD2气体和1 mol D2气体,一定温度下反应后生成LD3气体,当反应达到平衡时,D2的浓度为0.01 mol·L-1,同时放出约177 kJ的热量,则平衡时LD2的转化率为 ;该反应的热化学方程式为 ;此时该反应的平衡常数K= 。
(4) 有人设想寻求合适的催化剂和电极材料,以C2、A2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极反应式 ;
已知有以下物质相互转化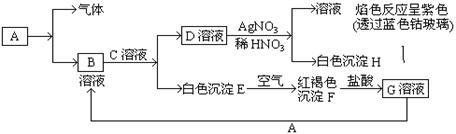
试回答:(1)写出B的化学式,D的化学式。
(2)写出由E转变成F的化学方程式。
(3)写出F转化成G的离子方程式;
(8分)以 ①2NaOH+ Cl2 NaCl+NaClO+H2O② 2Na + Cl2
NaCl+NaClO+H2O② 2Na + Cl2 2NaCl
2NaCl
③ 2Fe3+ + 2I– 2Fe2+ + I2 ④ 2Fe2+ + Br2
2Fe2+ + I2 ④ 2Fe2+ + Br2 2Fe3+ + 2Br–
2Fe3+ + 2Br–
这四个反应为例,我们来探究氧化还原反应。
(1)氧化还原反应的本质是。
(2)对于反应①,氧化剂是。
(3)对于反应②,Na的化合价由0价变成+1价,化合价升高的原因是。
(4)由③、④两反应,可以推断Fe3+、Br2、I2的氧化性强弱顺序为。
(1)鉴别KCl溶液和K2CO3的试剂是 ,离子方程式为 。
(2)除去混入NaCl溶液中少量NaHCO3杂质的试剂是 ,离子方程式为 。
(3)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为 。(3分)
A、B是中学化学里常见的物质,其中B是单质,A是化合物。各物质之间的转化关系如图所示: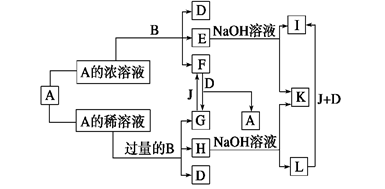
已知:往E溶液中滴加KSCN溶液时,溶液呈红色; A的浓溶液与B在常温下无明显反应现象。请回答:
(1)框图中B和A的浓溶液反应的条件是,而常温下无明显现象的原因是 _________ ____________________________________________ ;
(2)写出F和G相互转化的化学方程式:
F→G:;
G→F: __________ ;
(3)L转化成I的化学方程式是_____________________________________________。
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示:
由此可知,(1)该溶液中肯定含有的阳离子是____________________,且各阳离子的物质的量之比为_____________;肯定不含有的阳离子是___________;检验可能含有的某种阳离子的常用实验方法是;
(2)分别写出BC、CD段对应的离子方程式,并写出BC段参加反应的阳离子在实验室中常用的检验其存在的方法:BC:________________________________________;
检验:_____________________________________________;
CD:__________________________________________.