已知2A(g)+B(g) 2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
(1)能说明上述反应已经达到化学平衡状态的是 (填写序号);
a.v(C)=2v(B) b.容器内压强保持不变
c.v逆(A)=2v正(B) d.容器内气体的密度保持不变
(2)若在相同的容器中只加入0.050 mol C,500℃时充分反应达平衡后,吸收热量Q2kJ,则Q1与Q2之间的关系式可表示为 (用含Q1、Q2的代数式表示);
(3)500℃时,上述反应的化学平衡常数K= ;
(4)已知:K(300℃)>K(350℃),该反应是 (填“放”或“吸”)热反应;若反应温度升高,A的转化率 (填“增大”、“减小”或“不变”);
(5)某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A) K(B)(填“>”、“<”或“=”)。
雄黄(AS4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为。
(2)上述反应中的氧化剂是,反应产生的气体可用吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为。若将该反应设计成一原电池,则NO2应该在(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量(选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 |
a |
I |
e |
| 原子核数 |
单核 |
四核 |
双核 |
| 粒子的电荷数 |
一个单位正电荷 |
0 |
一个单位负电荷 |
物质A由a、e构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示: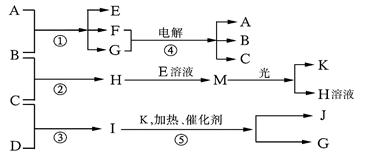
请填写下列空白:
(1)写出下列物质的化学式:BJ。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M。②I溶于G 。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为。
已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平。E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。
(1)A的结构式为__________,C的名称为__________。
(2)B分子中的官能团名称是_________。
(3)写出下列反应的化学方程式并指出反应类型:
①__________________________________________;反应类型是_____________;
④__________________________________________;反应类型是_____________。
Ⅰ.有下列各组物质:
| A.O2和O3(臭氧) |
B.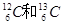 |
| C.CH3CH2CH2CH3和CH3CH(CH3)2 |
D.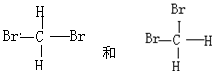 |
E.葡萄糖和果糖 F.(CH3)2CH2与C(CH3)4
G.淀粉和纤维素 H.液氯与氯气
(1)组两物质互为同位素(2)组两物质互为同素异形体
(3)组两物质属于同系物(4)组两组物质互为同分异构体
(5)组中的物质是同一物质(6)D中任意一者与氯气反应的一个化学方程式
Ⅱ.下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。
(1)图中属于烷烃的是(填编号下同)属于烯烃的是,
(2)上图中与B互为同分异构体但不属于同种类的物质的是:。
Ⅲ.某有机物气体含碳82.7%,含氢17.3%,在标准状况下它的密度是2.59g/L。则(1)此有机物的相对分子质量为__________;(2)此有机物的分子式为____________;其可能的结构简式为。
工业上冶炼铝时需用到一种熔剂冰晶石(Na3AlF6),工业制冰晶石的化学方程式为:2Al(OH)3+ 12HF+ 3Na2CO3=2Na3AlF6+ 3CO2↑+ 9H2O,根据题意完成下列填空:
(1)写出工业冶炼铝时阳极电极反应式。
(2)在上述反应的反应物和生成物中,属于酸性氧化物的化合物的电子式。
(3)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属强弱的是(选填编号)。
a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢
(4)反应物中某些元素处于同一周期。它们最高价氧化物对应的水化物之间发生反应的离子方程式为。