( 10分)有X、Y、Z三种元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。 请回答:
(1)Y的最高价氧化物对应水化物的化学式是____________
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是________________________,此液体具有的性质是__________________(填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为_________________________
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)溶液在一定条件下反应,可生成一种强酸和一种氧化物。若有1.5×6.02×1023个电子转移时,该反应的化学方程式是____________________________
焦亚硫酸钠(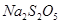 )常用作食品漂白剂,其制备工艺流程如下:
)常用作食品漂白剂,其制备工艺流程如下: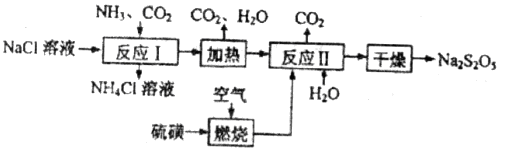
已知:反应Ⅱ包含 等多步反应。
等多步反应。
(1)反应Ⅰ的化学方程式为____________,反应Ⅰ进行时应先通入__________气体。
(2)硫磺燃烧前先加热成液态并通过喷嘴喷入焚硫炉中,目的是__________。在上述工艺流程中可循环使用的物质是_____________。
(3)反应Ⅱ中需控制参加反应的气体与固体的物质的量之比接近____________,若气体量不足,则会导致_______________。
(4)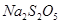 与稀硫酸反应放出
与稀硫酸反应放出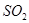 ,其离子方程式为___________。
,其离子方程式为___________。
“节能减排”,减少全球温室气体排放,意义十分重大。二氧化碳的捕捉与封存是实现温室气体减排的重要途径之一,科学家利用 溶液喷淋“捕捉”空气中的
溶液喷淋“捕捉”空气中的 。
。
(1)使用过量 溶液吸收
溶液吸收 ,反应的离子方程式为________;若含有3molNaOH的溶液“捕捉”了22.4L
,反应的离子方程式为________;若含有3molNaOH的溶液“捕捉”了22.4L 气体(标准状况),则所得溶液中钠与碳元素的物料守恒关系式为__________(用离子浓度的关系式表示)。
气体(标准状况),则所得溶液中钠与碳元素的物料守恒关系式为__________(用离子浓度的关系式表示)。
(2)①以 和
和 为原料可合成化肥尿素[
为原料可合成化肥尿素[ ]。已知:
]。已知:
 ①
①
 ②
②
 ③
③
试写出 和
和 合成尿素和液态水的热化学方程式__________。
合成尿素和液态水的热化学方程式__________。
② 通过反应可转化为
通过反应可转化为 ,在催化剂作用下CO和
,在催化剂作用下CO和 反应生成甲醇:
反应生成甲醇: 某容积可变的密闭容器中充有10molCO与20mol
某容积可变的密闭容器中充有10molCO与20mol ,CO的平衡转化率(a)与温度、压强的关系如下图所示。
,CO的平衡转化率(a)与温度、压强的关系如下图所示。
A.若A点表示在某时刻达到的平衡状态,此时容器的容积为VL,则该温度下的平衡常数K=__________;平衡状态B点时容器的容积 _______VL。(填“大于”、“小于”或“等于”)
_______VL。(填“大于”、“小于”或“等于”)
B.若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间 _______
_______ (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
C.在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是________(写出一种即可)。
铝是一种应用广泛的金属,工业上用 和冰晶石(
和冰晶石( )混合熔融电解制得。
)混合熔融电解制得。
①铝土矿的主要成分是 和
和 等。从铝土矿中提炼
等。从铝土矿中提炼 的流程如下:
的流程如下:
②以萤石( )和纯碱为原料制备冰晶石的流程如下:
)和纯碱为原料制备冰晶石的流程如下:
回答下列问题:
(1)写出反应1的化学方程式_________________________、________________________________;
(2)滤液Ⅰ中加入 生成的沉淀是___________,反应2的离子方程式为____ ___________________
生成的沉淀是___________,反应2的离子方程式为____ ___________________
(3)E常用作制作豆腐的添加剂,化合物C是____,写出由D制备冰晶石的化学方程式_______________;
X、Y是短周期同主族元素,Z是过渡元素,化合物 、
、 可发生如下转化。
可发生如下转化。
(1)X的元素符号为_________, 的化学式为_________。
的化学式为_________。
(2)蓝色溶液中含有的阴离子是_______________。
(3)过程②中发生反应的离子方程式为_______________。
已知:

为合成某种液晶材料的中间体M,有人提出如上不同的合成途径
(1)常温下,下列物质能与A发生反应的有(填序号)
a.苯 b.Br2/CCl4 c.乙酸乙酯 d.KMnO4/H+溶液
(2)M中官能团的名称是,由C→B反应类型为。
(3)由A催化加氢生成M的过程中,可能有中间生成物和(写结构简式)。
(4)检验B中是否含有C可选用的试剂是(任写一种名称)。
(5)物质B也可由C10H13Cl与NaOH水溶液共热生成,写出由C10H13Cl和NaOH水溶液共热反应的化学方程式。
(6)C的一种同分异构体E具有如下特点:
a.分子中含—OCH2CH3 b.苯环上只有两种化学环境不同的氢原子
写出E在一定条件下发生加聚反应的化学方程式。