化合物甲与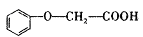 发生酯化反应的产物A是一种食用香料。11.6g甲完全燃烧可产生0.6mo1 CO2和0.6mo1 H2O。相同条件下,甲蒸气对氧气的相对密度为I. 8125,甲分子为链状结构且不含甲基。回答下列问题:
发生酯化反应的产物A是一种食用香料。11.6g甲完全燃烧可产生0.6mo1 CO2和0.6mo1 H2O。相同条件下,甲蒸气对氧气的相对密度为I. 8125,甲分子为链状结构且不含甲基。回答下列问题:
(1)甲中的结构简式为______________
(2)甲中含有的官能团名称为___________
(3)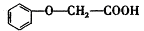 有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色,
有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色,
且苯环上的一氯代物有两种的同分异构体的结构简式为__________(任写两种)。(4)已知:
A的合成路线如下:
①试剂x不可选用____(填序号)
| A.NaOH落液 | B.Na2 C03溶液 | C.NaHC03溶液 | D.Na |
②乙的结构简式为_____,反应II的反应类型为________
③反应IV的化学方程式为_______________________
由金红石(TiO2)制取单质Ti,涉及的步骤为: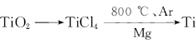
已知:①C(s)+O2(g)====CO2(g) ΔH=-393.5 kJ·mol-1
②2CO(g)+O2(g) ====2CO2(g) ΔH=-566 kJ·mol-1
③TiO2(s)+2Cl2(g) ====TiCl4(s)+O2(g) ΔH="+141" kJ·mol-1
则(1)TiO2(s)+2Cl2(g)+2C(s) ====TiCl4(s)+2CO(g)的ΔH=____________________。
(2)碳在氧气中不完全燃烧生成CO的热化学方程式为_______________________________。
(14分)用50ml 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是
。
(2)烧杯间填满碎纸条的作用是。
(3)实验中改用60 mL 0.50 mol·L-1的盐酸跟50mL 0.55 mol·L-1的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),理由是_____________________;所求中和热的数值会________(填“相等”或“不相等”),理由是_____________________。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”)。
2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。、
2SO3(g)反应过程的能量变化如图所示。、
已知1mol SO2(g)氧化为1mol SO3的ΔH= -99kJ·mol—1.请回答下列问题:(1)图中A、C分别表示、
,E的大小对该反应的反应热有无影响?。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,并说明理由;
(2)图中△H=;
(3)如果反应速率v(SO2)为0.05 mol·L—1·min—1,则v(O2)=mol·L—1·min—1
(4)已知单质硫的燃烧热为296 KJ·mol—1,计算由S(s)生成3 molSO3(g)的△H(要有计算过程)。
CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:
已知:①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
7.6 |
3.4 |
| 完全沉淀 |
4.1 |
9.7 |
9.2 |
5.2 |
请回答下列问题:
(1)加入过氧化氢的作用是(用离子方程式表示)。
(2)加入碳酸钠调节pH至a得到的滤渣可部分溶于氢氧化钠溶液, a的范围是。
(3)操作Ⅰ包含3个基本实验操作,它们是。
(4)制得的CoCl2·6H2O需减压烘干的原因是。
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合 成甲醇:
成甲醇:
反应Ⅰ: CO(g) + 2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g) ΔH2
ΔH2
①反应Ⅱ的平衡常数表达式是。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH10 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0 kJ/mol
③ H2O(g) = H2O(l)ΔH3=-44.0 kJ/mol
H2O(g) = H2O(l)ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:。
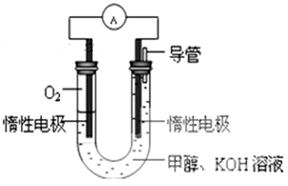
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。该电池正极的电极反应为。