10000C时,硫酸钠可与氢气发生反应:

 。请回答下列问题:
。请回答下列问题:
(1)上述反应的平衡常数表达式为: 。
(2)上述反应在三个不同条件下进行,其中H2的浓度随时间的变化如图所示。
①与曲线a比较,b和c分别仅改变一种反应条件,则曲线b改变的条件为
②该反应的△H___0(填“>”、“<”或“=”),其判断理由是 。
(3)该温度下,向2L盛有1.42g Na2SO4的密闭容器中通入H2,5min后测得
固体质量为1.10g。则该时间范围内的平均反应速率v(H2)= 。
(4)能说明该反应已达到平衡状态的是 (填字母,下同)。
a.容器内压强保持不变
b.容器内气体密度保持不变
c.c(H2)=c(H2O)d.v正(H2)=v逆(H2O)
(12分)通常情况下,微粒A和B为分子,C为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D。假定B的水溶液(B·H2O)和盐酸充分反应后的溶液为E。请用有关的化学式或微粒符号填空:
(1)用化学符号表示下列4种微粒:A:______;B:______;C:______;D:______。
(2)若E溶液中只有一种溶质,则该溶质中包含的化学键类型是:________,_________。电子式为:___________。该溶液中有关离子浓度的大小为:____________________。
(3)若E溶液是由体积相等的稀盐酸和B的水溶液混合而成,且恰好呈中性,则混合前c(HCl)________c(B·H2O)(填“大于”、“小于”或“等于”,下同);混合前盐酸中c(H+)和B·H2O中c(OH-)的关系为c(H+)________c(OH-)。
下图是一块用FeCl3溶液与Cu反应制作的印刷电路板,其制作原理可用下式表示: .
.
(1)上式中X物质的化学式为。
(2)在上述反应中,氧化剂为,氧化产物为,
将两者的氧化性比较,的氧化性更强。
(3)用双线桥法表示该反应的电子转移情况 。
(4)该反应的离子方程式为。
在H+、Mg2+、Fe2+、Fe3+、S2-、I-、S中,只有氧化性的是,
只有还原性的是 ,既有氧化性又有还原性的是_。
现有四瓶贴有A、B、C、D标签的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液。现进行如下实验,并记录部分现象(如下图)。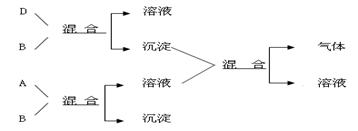
判断A是(写化学式,下同),B是,C是,D是。
B和D反应的离子方程式是
A和B反应的离子方程式。
Ⅰ、写出下列物质在水溶液中的电离方程式:
(1)Al2(SO4)3
(2)NaHCO3
Ⅱ、写出下列反应的离子方程式或化学方程式
(1)碳酸钠溶液与盐酸反应
(2)铁片插入到硝酸铜溶液中
(3)向氢氧化钙溶液加入足量碳酸氢钠溶液
(4)Ba2+ + SO42- =BaSO4 ↓
(5)Cu(OH)2 + 2H+=" Cu" 2+ + 2H2O