氯碱工业上通过电解饱和食盐水可得到氯气和氢气。已知100g 23.4%的饱和食盐水完全电解,问:
(1)生成氯气多少克?
(2)这些氯气中所含的分子数为多少?
(3)这些氯气在标准状况下的体积是多少升?
(4)若反应后溶液的总体积为100ml,则所得NaOH溶液的物质的量浓度是多少mol.L-1?
Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药、陶瓷釉药等。钡盐行业生产中排出大量的钡泥[主要含有BaCO3、 BaSO3、 Ba( FeO2)2等],某主要生产BaCO3、 BaSO4的化工厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下:
又已知:
①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ba(NO3)2晶体的分解温度:592℃;
③KSP(BaSO4)=1.lxl0-10, KSP(BaCO3)=5.1×10-9.
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。试用离子方程式说明提纯原理:______________。
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,反应的化学方程式为:
。
(3)该厂结合本厂实际,选用的X为(填序号);
| A.BaCl2 | B.BaCO3 | C.Ba(NO3)2 | D.Ba(OH)2 |
(4)中和I使溶液的pH为4~5目的是;
结合离子方程式简述原理。
(5)从Ba(NO3)2溶液中获得其晶体的操作方法是。
(6)测定所得Ba(NO3)2晶体的纯度:准确称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m克,则该晶体的纯度为。
(1)将不同量的CO(g)和H2O(g)分别通入体积2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1中以v(CO2)表示的平均反应速率为 (第二位小数)。
②该反应为 (填“吸热”或“放热”)反应。
③求实验2的平常常数K,要求写出计算过程,结果取二位小数。
(2)已知在常温常压下: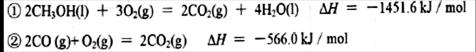
写出甲醇不完全燃烧生成CO和液态水的热化学方程式 。
(3)甲醇和氧气完全燃烧的反应可以设计为燃料电池,装置如图,该电池通过K2CO3溶液吸收反应生的CO2。则负极的电极反应为 。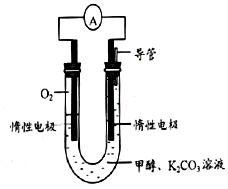
(4)CaCO3的KSP=2.8×10¯9。将等体积CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10¯4mol/L,则生成沉淀所需该CaCl2溶液的最小浓度为 。
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
____C+____K2Cr2O7 +=___CO2↑+ ____K2SO4 + ____Cr2(SO4)3+ ____H2O
请完成并配平上述化学方程式。
其中氧化剂是________________,氧化产物是_________________
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g) CH3OH(g)△H1=-116 kJ·mol-1
CH3OH(g)△H1=-116 kJ·mol-1
①已知: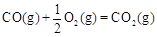 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1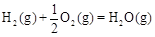 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为;
②在容积为1L的恒容容器中,分别研究在230℃、250℃
270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。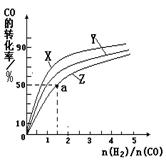
请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是。
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g) CH3OH(g)的平衡常数K=。
CH3OH(g)的平衡常数K=。
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
| 0min |
5min |
10min |
|
| CO |
0.1 |
0.05 |
|
| H2 |
0.2 |
0.2 |
|
| CH3OH |
0 |
0.04 |
0.05 |
若5min~10min只改变了某一条件,所改变的条件是;且该条件所改变的量是。
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇:
CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ CO(g)+2H2(g)
CO(g)+3H2(g)……Ⅰ CO(g)+2H2(g) CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100L反应室,在一定条件下发生反应I,CH4的平衡转化率与温度、压强的关系如图。
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为。
②图中的P1P2(填“<”、“>”或“=”),100℃时平衡常数的值为。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3amol H2的混合气体在催化剂作用下,自发反应Ⅱ,生成甲醇。
③该反应的△H0;若容器容积不变,下列措施可增加甲醇产率的是。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充入1mol CO和3mol H2 |
④为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 |
T(℃) |
n(CO)/n(H2) |
P(Mpa) |
| i |
150 |
1/3 |
0.1 |
| ii |
5 |
||
| iii |
350 |
5 |
a.请在上表空格中填入剩余的实验条件数据。
b.根据反应Ⅱ的特点,在给出的坐标图中,补画出在5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明压强。
消除汽车尾气是减少城市空气污染的热点研究课题。
(1)汽车内燃机工作时发生的反应N2(g) + O2(g) 2NO(g),生成的NO是汽车尾气的主要污染物。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol(不考虑后续反应)。则:
2NO(g),生成的NO是汽车尾气的主要污染物。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol(不考虑后续反应)。则:
①5 min内该反应的平均速率ν(NO) = ;在T ℃时,该反应的平衡常数K = 。
② 反应开始至达到平衡的过程中,容器中下列各项发生变化的是(填序号)。
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
(2)用H2或CO催化还原NO可以达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g)△H =" —180.5" kJ·mol-1
2H2O(l) =2H2(g) + O2(g)△H =" +571.6" kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是
。
(3)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应2NO(g) + 2CO(g)
 2CO2(g) + N2(g) 中,NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g) 中,NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
① 该反应的H0 (填“>”或“<”)。
②若催化剂的表面积S1>S2 ,在右图中画出c(NO) 在T1、 S2条件下达到平衡过程中的变化曲线(并作相应标注)。