向100mL18mol/L的H2SO4溶液中加入足量的铜片并加热,充分反应,再加入足量的锌片,充分反应后,被还原的H2SO4的物质的量 ( )
| A.小于0.9mol | B.等于0.9mol |
| C.在0.9mol与1.8mol之间 | D.等于1.8mol |
下列关于常见有机物的说法不正确的是
| A.石油和天然气的主要成分都是碳氢化合物 | |
B.糖类和蛋白质都是人体重要的营养物质 |
C.乙酸和油脂都能与氢氧化钠溶液反应 |
| D.乙烯和苯都能与溴水反应 |
下列各项中表达正确的是
A.氟原子的结构示意图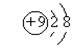 |
| B.丙烯的结构式 CH3—CH=CH2 |
| C.乙烷的结构简式 CH3CH3 |
D.NH3的电子式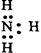 |
19世纪中叶,门捷列夫的突出贡献是
| A.提出了原子学说 | B.发现了元素周期律 |
| C.提出了分子学说 | D.发现质量守恒定律 |
在镁与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,则10s内生成氢气的平均反应速率是
某有机物燃烧后产物只有CO2和H2O,可推出的结论是,这种有机物中
A.一定只有C、H B.可能含有C、H、O
C.一定含有C、H、无O D.一定含有C、H、可能有O