下列各组离子在给定条件下的溶液中,可以大量共存的是
| A.在碱性溶液中 Na+、K+、ClO-、S2- |
| B.在pH=13的溶液中 Al3+、Na+、SO42-、Cl- |
| C.在水电离出的氢离子浓度为1×10-13的溶液中 Na+、NH4+、AlO2-、CO32- |
| D.在酸性溶液中 Na+、K+、MnO4-、NO3- |
某有机物的结构简式为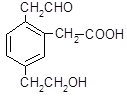 ,它在一定条件下可能发生的反应是()
,它在一定条件下可能发生的反应是()
①加成反应;②水解反应;③酯化反应;④氧化反应;⑤中和反应;⑥消去反应;⑦还原反应
| A.①③④⑤⑥⑦ | B.①③④⑤⑦ | C.①③⑤⑥⑦ | D.②③④⑤⑥ |
5种基团-CH3、-OH、-CHO、-C6H5(苯基)、-COOH,在由不同基团两两组成的物质中,能与NaOH反应的有机物有()
| A.4种 | B.5种 | C.6种 | D.7种 |
扑热息痛是一种优良的解热镇痛剂,其结构式为 。它不可能具有的化学性质是( )
。它不可能具有的化学性质是( )
| A.能与NaOH溶液反应 | B.能与浓溴水发生取代反应 |
| C.能被KMnO4酸性溶液氧化 | D.能发生消去反应 |
以下4种有机物的分子式都是C4H10O: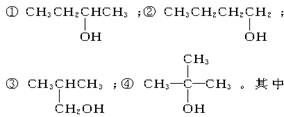
能被氧化成含相同碳原子数的醛的是()
| A.①② | B.只有② | C.②③ | D.③④ |
下列反应中,有机物被还原的是 ( )
| A.乙醛的银镜反应 | B.乙醛制乙醇 | C.乙醇制乙醛 | D.乙醇制乙烯 |