13.5g金属铝与1L 2mol•L-1 NaOH溶液充分反应,生成的气体在标准状况下的体积为( )
| A.67.2L | B.22.4L | C.16.8L | D.44.8L |
物质的量之比为2︰5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
| A.1︰4 | B.1︰5 | C.2︰3 | D.2︰5 |
W、X、Y、Z是元素周期表中前四周期元素,它们在周期表中的相对位置如图所示。下列有关叙述中正确的是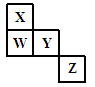
| A.Z元素一定是金属元素 |
| B.X、Y、W一定是主族元素 |
| C.若Y的单质既能与强酸溶液反应又能与强碱溶液反应,则W为ⅡA元素 |
| D.Z既可能在第三周期,也可能在第四周期 |
将3.20 g Cu跟30.0 mL 10 mol·L-1的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有a mol H+,则此时溶液中含NO3- 的物质的量为
| A.0.5a mol | B.2a mol | C.0.1a mol | D.(0.1+a)mol |
下列说法正确的是
| A.离子键就是使阴、阳离子结合成化合物的静电引力 |
| B.所有金属与所有非金属之间都能形成离子键 |
| C.在化合物CaCl2中,两个氯离子之间也存在离子键 |
| D.含有离子键的化合物一定是离子化合物 |
下列物质的性质比较,正确的是
| A.酸性:H2SO4>HClO4>HBrO4 | B.碱性:NaOH>KOH>RbOH |
| C.非金属性: P>S>Cl | D.气态氢化物稳定性:HF>H2O>PH3 |