某兴趣小组做了如下实验。
【实验一】提纯NaCl
请根据实验回答下列问题:
(1)操作①、②、③依次为下图中的(填序号) 。
(2)若得到NaCl的产率比实际值偏低,则可能的原因是(填序号) 。
A.过滤时滤纸有破损
B.蒸发时有固体溅出
C.蒸发时,看到晶体析出,立即停止加热
D.溶解11 g含有泥沙的NaCl时,加入的水量不足
(3)用上述实验所得的氯化钠配制5%的氯化钠溶液50 g,不需要的仪器为(填序号) 。
A.量筒 B.天平 C.烧杯 D.漏斗 E.蒸发皿 F.玻璃棒 G.酒精灯
【实验二】溶解和结晶KNO3
请根据实验和溶解度曲线回答下列问题(水的密度以1 g/mL计):
| 实验操作 |
实验结果 |
| 取20 mL水,加入5 g KNO3,搅拌,恢复至20℃ |
全部溶解,得溶液① |
| 再加X g KNO3,搅拌 |
恰好饱和,得溶液② |
| 再加5 g KNO3,搅拌 |
得溶液 ③ |
| 加热 |
全部溶解,得溶液④ |
| 冷却至20℃ |
晶体析出,母液⑤ |
(4)③中溶液的质量为 ;一定属于不饱和溶液的是(填数字序号) ;溶质的质量分数一定相等的是(填序号) 。
(5)析出晶体的质量为(填序号) 。
A.5 g B.X+5 g C.X+10 g
请你参与某学习小组研究性学习的过程,并协助完成相关任务。
【研究课题】探究水壶内部水垢的主要成分
【查阅资料】通过查阅资料知道,天然水和水垢所含的物质及其溶解性如下表:
| 物质 |
Ca(HCO3)2 |
Mg(HCO3)2 |
Ca(OH)2 |
Mg(OH)2 |
CaCO3 |
MgCO3 |
| 溶解性 |
可溶 |
可溶 |
微溶 |
不溶 |
不溶 |
微溶 |
【提出猜想】水垢的主要成分一定含有Mg(OH)2和 ,可能含有Ca(OH)2和。【设计方案】(1)甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,静置。取上层清液滴入Na2CO3溶液,如果没有白色沉淀,说明水垢中无(填化学式)。
(2)乙同学设计了下列实验装置,进一步确定水垢中含有碳酸盐的成分。其主要实验步骤如下: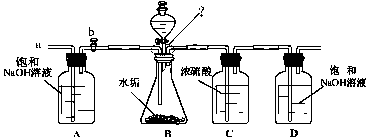
①按图组装仪器,将50g水垢试样放入锥形瓶中,逐滴加入足量稀盐酸。若D瓶增重22g,则水垢全部是CaCO3。②待锥形瓶中不再产生气泡时,打开活塞b,从导管a处缓缓鼓入一定量的空气;③称量D瓶内物质增加的质量;④重复②和③的操作,直至D瓶内物质质量不变。测量滴加稀盐酸体积与D瓶内物质增加质量的关系如下图曲线所示: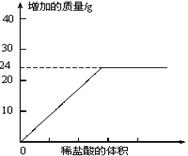
【评价】(1)A瓶中的NaOH溶液起到作用。若A瓶中无NaOH溶液,D瓶中的质量将(填“增大”、“不变”或“减小”)。
(2)一般情况下,两种不同金属形成的碳酸盐与足量盐酸反应时,若两金属的化合价相同、两种盐的质量相同,则相对分子质量小者放出的气体多。分析曲线图可知:水垢中一定含有
(化学式),理由是。
(3)以上实验(填“能够”或“不能”)检测出水垢中含有Mg(OH)2。
某无色废液可能含有硫酸钠、氢氧化钠、氯化钠、碳酸钠和氯化钡中的一种或几种物质。为探究其组成,小亮同学进行了下列实验:
(1)取少量废液放入试管中,滴加1-2滴无色酚酞溶液,溶液变成红色;再加入过量稀盐酸,溶液由红色变成无色,并有气泡产生。
根据以上实验,小亮同学得出结论:无色废液中一定含有碳酸钠,一定不含氢氧化钠和氯化钡,可能含有硫酸钠和氯化钠。
小强同学认为小亮的结论不正确,无色废液中可能还含有,证据是;(2)小亮同学继续开展实验,验证出原无色溶液中含有硫酸钠和氯化钠。
正确的操作及现象是:取少量无色废液于试管中,加入过量的稀硝酸,有气泡产生;再
,有白色沉淀生成,产生该白色沉淀的化学反应方程式为。
.现实验室中有一包由碳酸钠和氧化钙组成的白色粉末,下面是某化学兴趣小组的同学进行的探究过程,请你按要求帮助完成探究活动。
(1)同学们将白色固体放在如右图装置的试管中,打开分液漏斗开关,向试管中滴加水,观察到伸入烧杯中的导管口有气泡冒出,产生这种现象的原因是,产生这种现象涉及的化学方程式是。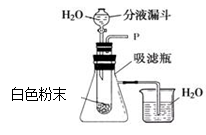
(2)同学们将如上图装置的试管中继续加入足量的水,发现试管中形成浑浊液体,于是同学们对浑浊液进行探究,其实验过程如下: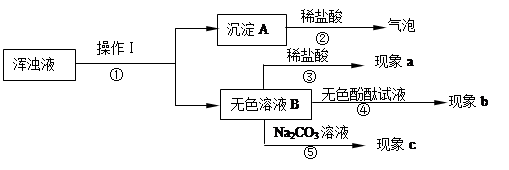
A.操作Ⅰ是,在该操作中用到的玻璃仪器有漏斗、烧杯和。
B.沉淀A的化学式是。同学们认为无色溶液B一定含有的溶质是,对无色溶液B含有的其它溶质他们提出二个猜想:
猜想1:无色溶液B中的溶质还有Na2CO3;
猜想2:无色溶液B中的溶质还有。
根据上面实验流程回答:现象b是。若猜想1成立,则现象a是,此时③反应的化学方程式是,若猜想2成立的现象是。
.请你参与下列探究过程:
(1)甲同学两根燃烧的蜡烛中的一根用玻璃杯罩住,发现玻璃杯中的蜡烛熄灭,说明燃烧的一个条件是,向另一根蜡烛用力吹气,发现蜡烛也熄灭,说明燃烧的另一个条件是。
(2)乙同学为了证明CO2确实与NaOH溶液发生反应,他设计了如下图装置进行实验,则B瓶中物质a是,证明能反应的实验现象是,充分反应后向A瓶中滴入CaCl2溶液,产生的现象是。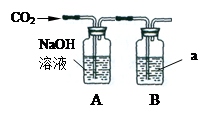
碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业。某化学兴趣小组的同学对碳酸氢钠的性质进行探究。
实验一:探究碳酸氢钠溶液的酸碱性
取碳酸氢钠溶液少许,滴加无色酚酞溶液变红,由此可知碳酸氢钠溶液呈性。
实验二:探究碳酸氢钠的热稳定性
[查阅资料]碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质。
[进行实验]为验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠到铜片上加热,如下图所示。
(1)加热一段时间后,观察到烧杯内壁有生成。
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊。写出该反应的化学方程式:。
(3)兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3。
①兴趣小组的同学猜想的依据是。
②请设计实验检验反应后的固体产物是NaOH还Na2CO3,并填入下表:
| 实验操作 |
预期实验现象 |
结论 |
| 取少量固体产物,向其中加入。 |
有气泡产生 |
固体产物是Na2CO3,而不是NaOH。 |
(4)写出碳酸氢钠加热分解的化学方程式。