下图所示对实验选用或实验操作正确的是 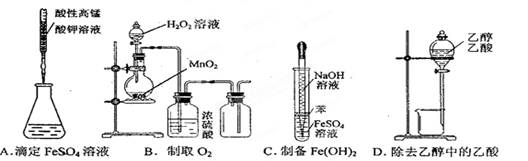
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外研究小组测定该补血剂中铁元素的含量,实验步骤如下: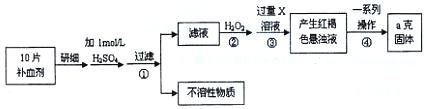
 请回答下列问题:
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加,该过程的现象为:。
(2)步骤②加入过量H2O2的目的:。
(3)步骤③中反应的离子方程式:。
(4)步骤④中一系列处理的操作步骤:过滤、、灼烧、、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行 铁元素含量的测定。(5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
铁元素含量的测定。(5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需。
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是__ __。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③滴定到终点时的颜色为色。
(9分)实验室用氯化钠固体配制100mL 1.0 mol·L-1的NaCl溶液,有如下操作步骤:
①用托盘天平称量____________g NaCl晶体放入小烧杯中,加适量蒸馏水溶解;
②继续向容 量瓶中加蒸馏水至液面距刻度线1-2cm处,改用_____________小心滴加蒸馏水至溶液凹液面的最低处与刻度线相切;
量瓶中加蒸馏水至液面距刻度线1-2cm处,改用_____________小心滴加蒸馏水至溶液凹液面的最低处与刻度线相切;
③把①中所得溶液小心地转入______________中;
④将容量瓶塞紧,充分摇匀;
⑤用少量蒸馏水洗涤烧杯与玻璃棒2-3次,洗涤液一并转移到容量瓶中。
(1)将上述步骤的空白处填空;
(2)本实验操作步骤的正确顺序是(填序号,不能重复);
(3)试分析下列操作对所配得溶液的浓度有何影响(填:“偏高”、“偏低”、或“无影响”)
①容量瓶用蒸馏水洗净后没有干燥就直接用来配溶液,所配得溶液的浓度;
②定容时,俯视刻度线,所配得溶液的浓度;
③定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。所配得溶液的浓度。
某学生用0.1×10×25mm3,质量分数≥99.5%的铝片和盐酸反应制取H2,实验现象见下表: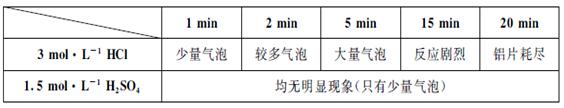
(1)写出铝片与盐酸、硫酸反应的离子方程式
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,15~20min内,反应速率逐渐减小。其原因是
(3)①根据铝片与盐酸和硫酸反应现象的差异,有学生对此现象提出如下猜想(至少要写出两种假设):
假设一:Cl-对该反应有促进作用,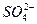 对该反应不影响。
对该反应不影响。
假设二:。
假设三:。]
假设四:。
③请你以“假设一”为实验课题,设计实验方案探究,要求写 出主要实验步骤。
出主要实验步骤。
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。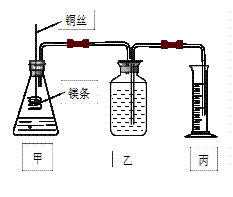
图1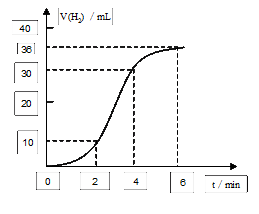
图2
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
|
在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因:_______________________________________________________
_________________________________________________________。 率是否变化。
率是否变化。
 论:Cl-对反应具有加速作用。
论:Cl-对反应具有加速作用。
如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞试液.在F极附近显红色。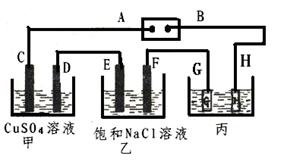
试回答以下问题:
(1)电极A的名称是。
(2)甲装置中D电极的电极反应式: ______________________________。
(3) 在25℃时若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生5.6L(标准状况下)一种气体,电解后溶液体积为50L时,求所得溶液在25℃时的氢氧化钠物质的量浓度=________。
(4)欲用丙装置给铜镀银,G应该是____(填“银”或“铜”),电镀液的主要成分是(填化学式)。