小丽来到实验室,看到实验桌上有一瓶敞口放置的氢氧化钠固体,于是对其是否变质产生了兴趣。她和同学们准备对这瓶固体进行探究。
【查阅资料】a.碳酸钠溶液显碱性,氯化钙溶液呈中性。
b.碳酸钠溶液与氯化钙溶液可以发生反应:Na2CO3 + CaCl2=CaCO3↓+2NaCl。
【作出猜想】猜想1.固体没有变质
猜想2.固体部分变质
猜想3.
【设计方案】
| |
实验操作 |
实验现象 |
实验结论 |
| 方案一 |
取少量固体放入试管中,滴加几滴稀盐酸 |
无明显现象 |
猜想1正确 |
| 方案二 |
取少量固体放入试管中加水溶解,滴加足量澄清石灰水 |
产生白色沉淀 |
猜想2正确 |
| 取上层清液放入另一只试管中,滴加酚酞溶液 |
溶液变为红色 |
同学们经过讨论,认为两个方案都不合理。方案一不合理的原因是 ;
方案二不合理的原因是 。同学们重新设计了方案并进行了实验。
【实验探究】
| 实验操作 |
实验现象 |
实验结论 |
| 取少量固体放入试管中加水溶解,滴加足量 |
产生白色沉淀 |
猜想2正确 |
| 取上层清液放入另一只试管中,滴加酚酞溶液 |
|
若猜想3正确,该实验的现象应该是 。
【继续探究】同学们继续探究该氢氧化钠固体样品中碳酸钠的质量分数。利用以下装置进行了实验。
你认为她们需要测的数据是 (填字母序号)。
a.固体样品的质量 b.碱石灰实验前后的质量
c.浓硫酸实验前后的质量 d.氢氧化钠溶液实验前后的质量
e.所用稀硫酸的质量
【实验反思】根据所得数据进行计算发现结果比实际偏小,原因可能是 。
在煤矿的坑道里,若通风不好,遇有明火就会发生瓦斯爆炸事故,写出瓦斯气体(主要成分为甲烷)发生爆炸的化学方程式。
【提出问题】甲烷在空气中的含量占多少时,遇有明火一定会发生爆炸?
【查阅资料】甲烷在空气中的爆炸极限为含甲烷5%~15%.
【设计实验】取一个塑料瓶(容积575mL)、一支电子点火枪、胶塞,组装装置如图所示。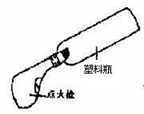
根据爆炸极限,取用30~70mL不同体积甲烷8份,每份都重复实验3次,实验结果如下:(注“√”表示发生爆鸣,“×”表示未发生爆鸣)
| 甲烷的体积(mL) |
30 |
40 |
45 |
50 |
55 |
60 |
65 |
70 |
|
| 占总体积的百分数(%) |
5.2 |
7.0 |
7.8 |
8.7 |
10.4 |
11.3 |
12.2 |
||
| 实验 次数 |
1 |
× |
√ |
× |
√ |
√ |
√ |
× |
× |
| 2 |
× |
× |
√ |
× |
√ |
√ |
× |
× |
|
| 3 |
× |
× |
× |
√ |
√ |
× |
√ |
× |
⑴每份都重复实验3次,目的是。
⑵分析上表,甲烷为mL,占总体积的百分数为%时,一定发生爆炸。
⑶甲烷占总体积的百分数在范围内可能会出现爆鸣现象。
⑷由实验分析可知当空气中含甲烷5%~15%,点燃时是否一定会发生爆炸?。(填“一定”或“不一定”)
⑸分析上述实验中未发生爆炸的原因(写出一条)。
碳酸钠是一种重要的盐类物质,某同学设计实验对碳酸钠的部分性质进行了探究。请你一起参与探究活动
(1)【探究实验一】 碳酸钠溶液的酸碱性
【实验方案】 取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞试液,振荡。
现象:溶液变成浅红色。结论:。
(2)【探究实验二】 能与碱反应。
【实验方案】取少量该固体加入试管中,加适量水溶解,再滴入澄清石灰水,振荡。
现象:。反应的化学方程式为: 。
某实验小组的同学在加热铜与浓硫酸的混合物实验时,发现生成了一种无色有刺激性气味的气体和蓝色溶液,进行如下探究活动.
[查阅资料]①某些不活泼的金属(如铜)能与一些强氧化性的酸(如浓硫酸)发生反应,生成水而不生成氢气,同时生成二氧化硫和铜盐.
②硫酸铜溶于水后,溶液呈酸性.
[知识回顾]铜、银_______(能、不能)与稀硫酸、盐酸反应产生氢气.
[分析讨论]⑴对于生成的蓝色溶液,小东认为可能是Cu(NO3)2溶液,小楠认为不可能是Cu(NO3)2溶液,而可能是硫酸铜溶液,小楠的理由是.
⑵写出铜与浓硫酸共热的化学方程式.
⑶小东根据化学方程式说,该方法适用于以铜为原料大量制取硫酸铜,小田认为不适宜,你能说出小田的一个理由吗.
[提出问题]上述蓝色溶液中有无硫酸剩余?
[实验论证]小坤认为可向蓝色溶液中滴加氯化钡溶液,观察有无沉淀产生,经大家讨论后,该方案被否定,你觉得否定该方案的理由是.
[反思评价]⑴有同学提问:为什么不可以用石蕊试液来进行检验?你的回答是.
⑵同学们发现:将足量的铜和足量的浓硫酸置于容器中加热,一段时间后,反应会逐渐变慢,最后反应停止,你能说出反应停止的原因吗? .
某研究性学习小组为探究镁与水的反应,设计如下实验:
步骤1:将镁条用砂纸打磨至光亮,分成两等份.
步骤2:将一份光亮的镁条置于冷水中,几乎没有观察到任何现象.
步骤3:将另一份光亮的镁条置于热水中,观察到有均匀的气泡产生.
(1)将镁条用砂纸打磨至光亮的目的是.
(2)步骤2中没有观察到任何现象,不能说明镁条与冷水不反应,请举出学习过的一个实例
说明:.
经查阅资料:活泼金属与水反应生成对应的碱和氢气,如果金属活动性越强,生成的碱就越强.某同学就向步骤2的烧杯中滴加酚酞试液,观察到镁条的表面有明显的红色出现,但是红色较淡.该反应的化学方程式为,由于Mg(OH)2难溶于水,因此形成的溶液碱性较弱.
(3)步骤2和3对比可知,影响镁与水的反应速率的一个条件是,
为检验生成的气体是氢气,可以采用的方法.
以下是甲、乙两同学对有关镁与盐酸反应的系列研究研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:
(1)实验时需将镁条进行打磨,其目的是。
(2) 反应中试管外壁发烫,说明镁与稀盐酸反应是反应(填“吸热”或“放热”),化学方程式为
(3)实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,则t1~t2时间内反应速率逐渐加快的主要原因是。
研究二.反应后所得溶液的酸碱性探究
【发现问题】
(1)反应后甲同学用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶液呈性,(选填“酸”“碱”或“中”)。
(2)反应后乙同学的试管中镁条有剩余,向试液中滴入两滴酚酞溶液,振荡显红色,说明乙同学所得溶液呈性。对此现象,乙同学重复如上实验,得到同样结果。
【提出猜想】
甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;猜想Ⅱ:氯化镁溶液pH小于7。
乙同学:猜想Ⅰ:氯化镁溶液使酚酞变红色;猜想Ⅱ:镁与热水反应使酚酞变红色。
【实验与思考】
为验证猜想,甲、乙两同学均需测定________溶液的酸碱性,实验表明该溶液显弱酸性。
乙同学为完成猜想Ⅱ,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,请根据实验现象写出镁与水反应的化学反应方程式。
【结论】
镁与稀盐酸反应,镁反应完全后所得溶液显酸性;
镁与稀盐酸反应,镁过量时所得溶液显碱性。
【拓展与延伸】
(1)金属氯化物的水溶液可能显中性或弱酸性;与金属的活动性顺序有关,如氯化钠溶液显中性,氯化镁溶液显弱酸性,氯化钾溶液显________性。
(2)活泼金属能与水在一定条件下反应。实验发现钠与冷水剧烈反应,产生大量的气体。由此可见金属与水反应与金属的活动性顺序_______(填“有关”或“无关”)。
研究三. 金属活动性强弱与原子结构的关系
下图为镁原子、钙原子和钡离子结构示意图,据此推测,这三种金属的活动性最强的是
__________________。