轻质碳酸钙可用作牙膏摩擦剂。工业上常用石灰石(含有少量杂质)来制备比较纯净的轻质碳酸钙。
已知:①石灰石高温煅烧可以生成生石灰和二氧化碳,此外还有少量不反应的杂质剩余。
②生石灰与水充分反应后可得到颗粒非常细小的熟石灰浆。
某实验小组同学设计了2种转化流程,如下图所示。
请回答下列问题:
(1)石灰石高温煅烧反应的化学方程式是 。
(2)物质B为 。
(3)反应④的化学方程式是 。
(4)操作Ⅱ应采用的方法是 。
(5)采用反应①②③制备轻质碳酸钙的方法优点有(写出一种即可) ;采用反应①②④制备轻质碳酸钙的方法优点有(写出一种即可) 。
小明同学将一块光亮的纯铜片放在酒精灯火焰上灼烧,发现铜片表面全部变黑.请你一起参与以下探究.
(1)提出问题:黑色物质的成分是什么? (2)查阅资料:①酒精在不完全燃烧时会产生炭黑.
②炭黑不与稀酸反应,也不溶于稀酸;氧化铜可与稀酸反应而溶解.
(3)猜想与假设:黑色物质可能是a:氧化铜,b:炭黑,c:
(4)实验方案:取一小片变黑的铜片,放入盛有足量(填化学式)溶液的试管中,观察现象.
(5)现象与结论:若现象是,则猜想a正确,试写出发生反应的化学方程式;
现用下列装置制取初中常见的气体。请回答。
AB CD EF
(1)写出仪器①、②的名称:①是,②是。
(2)实验室中,用加热氯酸钾和二氧化锰的混合物的方法制取氧气,发生装置可选用(填标号);该反应的化学方程式为 。
(3)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应),通过以下四步实验操作可回收二氧化锰。正确操作的先后顺序是。(填写选项序号)
| A.烘干 | B.溶解 | C.过滤 | D.洗涤 |
(4)实验室常用锌粒与稀硫酸反应来制氢气,其化学方程式为。收集氢气的装置可选用或。(填标号)
氨气是一种具有强烈刺激性气味的气体,密度比空气小,极易溶于水,其水溶液显碱性,实验室可用加热氯化铵与氢氧化钙固体混合物来制取氨气。右图是实验室常用
的制取气体的装置。
(1)请选择实验室制取氨气的发生装置,并写出用此装置制取另一气体的化学方程式。
(2)若在C装置中盛满水,用排水法收集氧气,则气体应该从哪端通入?若用C装置来收集氨气,则气体应该从哪端通入?
(3)图乙是利用氨气做的一个趣味实验(夹持设备已略去),烧瓶中装有干燥的氨气,胶头滴管中装有水,先关闭阀门,将胶头滴管中的水挤入烧瓶内,然后打开阀门,请你描述烧瓶中可能出现的现象。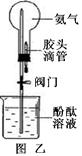
某化学兴趣小组按以下步骤探究某一温度下氯化钠饱和溶液的酸碱度。
[猜想或假设]溶液的pH可能为(请将你的假设填入空格中):①pH < 7 ,②____________ ,③____________ 。
[设计和实验]要测定该溶液的酸碱度,除有正确的操作步骤外,其中不能采用下列物质中的______________(填序号)来进行实验。
①pH试纸②紫色石蕊试液③酚酞试液
组内同学进行了如下实验:
甲同学:取pH试纸放在玻璃片上,用玻璃棒蘸取氯化钠溶液沾在pH试纸上,把试纸显示的颜色与标准比色卡比较,测得pH=7。
乙同学:取pH试纸放在玻璃片上,先用蒸馏水将pH试纸湿润,然后用玻璃棒蘸取氯化钠溶液沾在pH试纸上,把试纸显示的颜色与标准比色卡比较,测得pH=7。
丙同学:将pH试纸直接浸入氯化钠溶液中,把试纸显示的颜色与标准比色卡比较,测得pH=7。
[评 价]三位同学中操作规范的是_________同学。指出其余同学操作上的错误____________________________________________________。
[结论和分析]丙同学得出:“凡是盐溶液的pH都等于7”,你认为该结论是否正确?_______,如不正确请举一例说明(如正确,此空不用填)。_______________________________________________________
请你根据以下实验要求从中选出所需合适仪器的编号,并写在横线上。
 |
(1)镁条燃烧时,夹持镁条用
(2)配制一定溶质质量分数的硝酸钾溶液用。
(3)粗盐提纯时蒸发滤液所用到的仪器是。
(4)在⑵、⑶两组实验操作中都缺少的一种仪器是(填名称)。