氨气是一种具有强烈刺激性气味的气体,密度比空气小,极易溶于水,其水溶液显碱性,实验室可用加热氯化铵与氢氧化钙固体混合物来制取氨气。右图是实验室常用
的制取气体的装置。
(1)请选择实验室制取氨气的发生装置,并写出用此装置制取另一气体的化学方程式。
(2)若在C装置中盛满水,用排水法收集氧气,则气体应该从哪端通入?若用C装置来收集氨气,则气体应该从哪端通入?
(3)图乙是利用氨气做的一个趣味实验(夹持设备已略去),烧瓶中装有干燥的氨气,胶头滴管中装有水,先关闭阀门,将胶头滴管中的水挤入烧瓶内,然后打开阀门,请你描述烧瓶中可能出现的现象。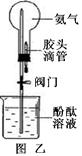
美丽的青海湖不仅让我们感受到自然之美,当地的居民还能从青海湖内“冬天捞碱、夏天捞盐”。当地学校的某化学兴趣小组对捞出来的纯碱进行研究,有的同学认为捞出来的全是碳酸钠,有的同学认为捞出来的纯碱中混有少量的氯化钠。现在他们准备以一包冬天捞出来的纯碱(若含有杂质,只考虑为氯化钠)为研究对象,探究该纯碱样品中碳酸钠的质量分数。小组通过讨论设计了下图中的装置,请你参与探究。(实验前活塞都关闭)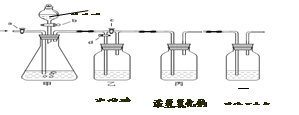
【实验一】称取13.25g纯碱样品完全溶于水,放入甲中,称量丙装置的质量为355g,打开
b、c,甲中现象为时,再称量丙装置的质量为350.6g,通过计算得出纯碱样品中
碳酸钠的质量分数为。甲和丙中反应的化学方程式为、。
同学们通过讨论认为上述方法并不能准确测量,其理由可能是。(写一条即可)
【实验二】通过讨论,改进后的实验步骤如下:
①称量丙装置的质量。
②称量样品,检查装置气密性。
③关闭a,打开b,注入足量的稀盐酸。
④打开a、d,鼓入氮气一会儿。
其正确顺序为 (填字序号,可重复)。
【表达与交流】
(1)此实验中丁装置的作用是 。
(2)此实验中鼓入氮气的作用是 。(2分)
根据下图所示制备气体的装置,回答下列问题(装置选择可用序号填写)。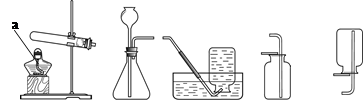
A B C D E
(1)标有字母“a”的仪器名称是。
(2)用高锰酸钾制取氧气时,有关反应的化学方程式为,应选用的装置是。
(3)用石灰石和稀盐酸制取二氧化碳的化学方程式为,所选用的发生装置是,收集装置是,用燃着的木条检验二氧化碳是否收集满时,可观察到的现象是。
过氧化钠(Na2O2)是一种淡黄色固体。在一次科技活动中,同学们将包有Na2O2固体的棉花放入了如右图所示的装置中,发现高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭,同时也惊奇地发现棉花燃烧了起来。
(1)实验过程中蜡烛由下往上依次熄灭,说明二氧化碳
具有、 的性质。
(2)棉花为什么会燃烧呢?同学们认为棉花要燃烧,除了满足棉花是可燃物之外,还需
满足、。
【提出问题】上述实验中是如何给棉花提供燃烧条件的?
【查阅资料】1.在常温下Na2O2与CO2、H2O均能发生化学反应。
2.无水硫酸铜为白色固体,吸水后变为蓝色。
【实验设计】经过讨论,同学们设计用下图所示装置进行实验探究。
【实验步骤】①检查整套装置的气密性;
②把相关的试剂放入对应的仪器内;③用力推动针筒的活塞,把稀盐酸注入试管内;
④一段时间后,在P处放置一根带火星的木条,观察现象。
注意:整个实验过程中不考虑稀盐酸的挥发和空气对实验的影响。
【实验现象】①带火星的木条复燃②无水硫酸铜没有变蓝色③饱和的澄清石灰水变浑浊。
【实验分析】D装置烧杯内澄清石灰水变浑浊的原因是。
【实验结论】①Na2O2和CO2反应生成一种气体,使图1中的棉花满足了燃烧的一个条件。
②使图1中的棉花满足了燃烧的另一条件是:Na2O2和CO2反应过程中(填放热或吸热)
【拓展提高】①Na2O2和CO2反应除生成一种气体外,还生成了一种固体,学生甲认为生成的固体是NaOH,学生乙认为是Na2CO3,同学们经思考后认为 同学的猜想是错误的,理由是 。
②写出Na2O2和CO2反应的化学方程式 。
根据下列装置,结合所学化学知识回答下列问题。
(1)请写出图中标号仪器的名称:① ;②。
(2)实验室制取少量二氧化碳时,发生装置最好选用,收集装置选用;
如需随时控制生产气体的量并节约药品,发生装置最好选用(填编号)
(3)实验室用高锰酸钾制取氧气时,发生装置应选用(填编号);写出其反应的化学方程式。
(4)如用E装置收集O2,检验O2是否收集满的方法是 。
某兴趣小组利用下图装置(夹持装置略去),测定某种补钙剂中的含钙量。
【查得资料】
①该补钙剂的主要成分是碳酸钙,其他成分遇到盐酸时无气体生成且不含钙元素。② 二氧化碳通入足量的氢氧化钡溶液中,会生成白色碳酸钡沉淀[Ba(OH)2+CO2 = BaCO3↓+H2O]
【测定方法】
通过测定B装置中产生沉淀的质量,以确定碳酸钙的质量分数,进而求出钙元素的质量分数。
(1)碳酸钙属于________( 填“酸”、“碱”或“盐”)。
【进行实验】
实验过程中,装置气密性良好。取12g该补钙剂样品进行实验。
(2)观察到:A装置中________,固体逐渐溶解;B装置中产生白色沉淀,实验结束后过滤并称得沉淀质量为19.7g,则该补钙剂中钙元素的质量分数为%。(结果精确到0.1% )
(3)从A装置中导出的气体除了二氧化碳和水蒸气外,还含有氯化氢。请写出氢氧化钡溶液与氯化氢气体反应的化学方程式:________。
【交流讨论】
通过小组讨论提出改进实验装置的措施:在A、B装置之间增加洗气装置,以除去氯化氢气体。
(4)经改进后,实验。
(5)C装置的作用是______。