现有下列物质:①乙炔 ②苯酚溶液 ③乙醛 ④淀粉溶液 ⑤氨基酸。请回答:
(1)遇碘水呈蓝色的是 (填序号,下同)。
(2)能发生成肽反应的是 。
(3)能跟溴发生加成反应的是 。
(4)能跟银氨溶液发生银镜反应的是 。
(5)能跟饱和溴水反应生成白色沉淀的是 。
(本小题满分15分)
某废液中含有大量的 K+ 、Cl- 、Br-,还有少量的 Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2),设计了如下流程图:
可供试剂 a、试剂 b(试剂 b代表一组试剂)选择的试剂:饱和 Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O溶液(H+)、KMnO4溶液(H+)、
稀盐酸。
请根据流程图,回答相关问题:
(1)操作⑤中用到的瓷质仪器名称是_____________。
(2)操作①②③④⑤的名称是_____________(填字母)。
| A.萃取、过滤、分液、过滤、蒸发结晶 |
| B.萃取、分液、蒸馏、过滤、蒸发结晶 |
| C.分液、萃取、过滤、过滤、蒸发结晶 |
| D.萃取、分液、分液、过滤、蒸发结晶 |
(3)试剂a应该选用_____________,反应的离子方程式为_________________。
(4)除去无色液体Ⅰ中的Ca 2+、Mg2+、SO42-,选出试剂b所代表的试剂,按滴加顺序依次是_________(填化学式)。
(5)调节pH的作用是_____________,涉及的化学方程式有_____________、_____________。
(15 分)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,根据要求解决下列问題:
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为 。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
①电解时发生反应的化学方程式为 。
②溶液X中大量存在的阴离子有__________________。
③除去ClO2中的NH3可选用的试剂是 (填标号)。
a.水b.碱石灰c.浓硫酸 d.饱和食盐水
(3)为了测定混合气体中ClO2的含量,我们通常用酸化的KI溶液与之反应。
①请写出ClO2与碘化钾反应的离子方程式为 。
②如果反应过程中共消耗了 0.04 mol的KI,则此混合气体中ClO2的质量为________克。
甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
① CO(g) + 2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
② CO2(g) + 3H2(g) CH3OH(g)+ H2O(g) △H2
CH3OH(g)+ H2O(g) △H2
③ CO2(g) + H2(g) CO(g) + H2O(g)△H3
CO(g) + H2O(g)△H3
回答下列问题:
(1)已知
| 化学键 |
H-H |
C-O |
C=O |
H-O |
C-H |
| E/(kJ.mol-1) |
436 |
343 |
1076 |
465 |
413 |
则△H1= kJ.mol-1
(2)图1中能正确表现反应①的平衡常数K随温度变化关系的曲线为 (填曲线标记字母),判断理由是 。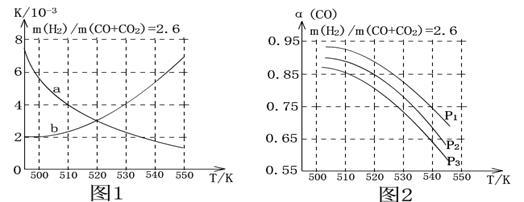
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而 (填“增大”或“减小”)原因是 。
图2中的压强由大到小为 ,判断理由是 。
氨是合成硝酸、铵盐和氮肥的基本原料,请问:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol•L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示, 若生成1mol N2,其△H= kJ•mol-1。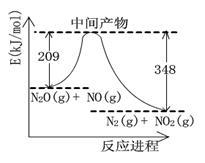
[化学—选修(三)物质结构与性质]
铁是最常见的金属材料。铁能形成 [Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物。
(1)基态Fe3+的M层电子排布式为 ;
(2)尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 、 ;
(3)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。 Fe(CO)x常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于______ (填晶体类型)。
(4)常温条件下,铁的晶体采用如图所示的堆积方式。则这种堆积模型的配位数为 ,如果铁的原子半径为a cm,阿伏加德常数的值为NA,则此种铁单质的密度表达式为 g/cm3。