某校兴趣小组同学准备进行常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中(如下图),有一装溶液的试剂瓶未盖瓶盖且标签破损,于是决定对这瓶溶液进行实验探究:
【提出问题】这瓶溶液是什么溶液?
【查阅资料】(1)酸、碱、盐的性质实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳酸钠。
(2)碱性的Na2CO3溶液与中性的CaCl2溶液发生复分解反应。
【提出猜想】猜想一:这瓶溶液是:氯化钠溶液;
猜想二:这瓶溶液是:碳酸钠溶液;
猜想三:这瓶溶液是: 。
【实验验证】为了验证上述猜想是否正确,该兴趣小组的同学进行了如下实验探究活动
实验一:验证猜想一和猜想二
| 序号 |
实验操作 |
主要实验现象 |
实验结论和解释 |
| ① |
取少量该溶液于一支试管中,向其中滴加2—3滴无色酚酞试液。 |
无色酚酞试液变红 |
该溶液不可能是 。理由是 。 |
| ② |
另取少量该溶液于一支试管中,向其中滴加足量的稀盐酸。 |
。 |
溶液中一定含有的溶质是碳酸钠,有关反应的化学方程式为 。 |
由此,兴趣小组的同学得出结论:该溶液是碳酸钠溶液。你认为,该结论是否正确?理由是 。
实验二:验证猜想三
| 实验操作 |
主要实验现象 |
实验结论和解释 |
| 。 |
。 |
该溶液是氢氧化钠溶液。 |
(7分)科学探究是学习化学常用的一种重要方法,下面某校化学兴趣小组同学的探究过程.
[发现问题] 加热铜与浓硫酸的混合物,能生成一种无色有刺激性气味的气体和蓝色溶液。
[查阅资料] ① 某些不活泼的金属(如铜)能与一些强氧化性的酸(如浓硫酸)发生反应,生成水而不生成氢气,同时生成二氧化硫和铜盐。
② 硫酸铜溶液呈酸性。
[知识回顾] 铜、银(填能或不能)与稀硫酸反应产生氢气。
[分析讨论]
(1)对于生成的蓝色溶液,小东认为可能是Cu(NO3)2溶液,小楠认为不可能是Cu(NO3)2溶液,而应该是硫酸铜溶液,小楠的理由是。
(2)写出铜与浓硫酸共热的化学方程式。
(3)小东根据化学方程式说,该方法适用于以铜为原料大量制取硫酸铜,小田认为不适宜,你能说出小田的一个理由吗。
[提出问题]上述蓝色溶液中有无硫酸剩余?
[讨论交流]
①小坤认为可向蓝色溶液中滴加氯化钡溶液,观察有无沉淀产生,经大家讨论后该方案被否定,你觉得否定该方案的理由是。
②小东同学认为可以直接用石蕊试液来进行检验。小田认为不对,她的理由是。
[反思评价]同学们又发现:将足量的铜和一定量的浓硫酸置于容器中加热,反应一段时间后,会逐渐变慢,最后停止,其中可能的原因是。
9分)常见的食品脱氧剂多为无机铁系脱氧剂,其主要成分为活性铁粉。脱氧中的一步主要反应为:4Fe(OH)2+ O2+ 2H2O = 4Fe(OH)3 (红褐色固体)Fe(OH)2读作;此反应的基本类型是。
某同学用食品脱氧剂(2g铁粉、0.5g活性炭、0.5g食盐)进行如下两个实验:
实验Ⅰ:
请回答:①操作Ⅰ的名称是,
②溶液丙中含有的阳离子是(写微粒符号)
实验Ⅱ:将乙洗涤烘干后,二氧化碳通过灼热的乙生成丁。
进行如下实验,物质之间的转化关系如下图(部分产物略去)。
①金属A与B的活动性:AB(填“﹥”“﹤”或“﹦”);
②区别有色溶液C与有色溶液D的方法是
;
③反应①③的化学方程式为:,,
④向溶液C中加入BaCl2溶液,有白色沉淀产生。其化学方程式为。
小明和小艳在实验室配制石灰水时,小明同学将两药匙熟石灰样品放入小烧杯中,向其中加入一定量的蒸馏水,充分搅拌后发现烧杯底部仍有不溶性的固体,于是他认为熟石灰样品已经变质。小艳同学不同意他的判断,你认为小艳同学的理由是(1)。针对该熟石灰样品的成分同学们展开了讨论,请你参与讨论并完成实验报告。
【提出问题】熟石灰样品的主要成分是什么?
【作出猜想】甲同学猜想是Ca(OH)2;乙同学猜想是CaCO3;你的猜想是(2)。
【实验与结论】请你通过实验验证你的猜想:
| 实验步骤 |
实验现象 |
实验结论 |
| 取少量的熟石灰样品于烧杯中,加适量的水充分溶解后过滤。 向滤液中加入适量(3)溶液; 向滤出固体中加入适量(5)溶液。 |
(4); (5)。 |
猜想正确 |
【拓展与应用】小组同学反思了熟石灰变质的原因,认识到实验室应(7)保存熟石灰。
(5分)探究碳酸氢钠的热稳定性
【查阅资料】碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质。
【进行实验】为验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠放在铜片上加热,如下图所示。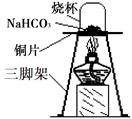
加热一段时间后,观察到烧杯内壁有。
充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊。写出该反应的化学方程式:。
兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3。
①他们猜想的依据是。
②设计实验,检验反应后的固体产物是Na2CO3而不是NaOH,并填入下表
| 实验操作 |
预期实验现象 |
结论 |
| 固体产物是Na2CO3,而不是NaOH。 |
(7分)小明在查阅资料时得知CO2在高温时能与木炭反应生成CO ,他决定对该反应进行探究。
【提出问题】CO2与木炭在高温条件下反应是否生成CO?
【实验探究】小明设计了下图的实验方案,并进行实验。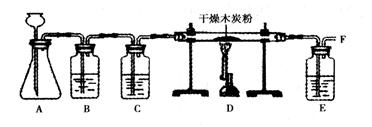
A中用石灰石与稀盐酸反应的化学方程式为___________________。
检查装置A气密性的方法是__________________________________________
B中装有饱和碳酸氢钠溶液,其作用是除去CO2气体中混有的少量HCl气体。C中装有浓硫酸,其作用是__________________
E中氢氧化钠溶液的作用是__________________。
【实验结论】经检验F处的气体为CO。结论:CO2在高温条件下与木炭反应生成了CO。
【实验反思】
有同学对A装置作如下改进:在锥形瓶中放入一小试管,将长颈漏斗下端插入小试管中,改进后的优点是_________________。
【实验拓展】
撤去B,按A→C→D→E顺序连接。然后A中用二氧化锰和过氧化氢溶液混合生成O2,反应的化学方程式为_________________。此时要检验该实验条件下D中木炭所发生反应的所有生成物,除在F处点燃并检验生成物外,还需要补充和完善的实验是________________。