(17分)某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
已知:①FeO + 2H+ = Fe2+ + H2O②Fe2O3 + 6H+ = 2Fe3+ +3 H2O ③Fe3O4 + 8H+ = Fe2+ +2Fe3+ +4 H2O
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为 。
(2)该同学欲确定反应一段时间后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意) ,若溶液未变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意) 。
| A.一定有Fe3O4,可能有Fe | B.只有Fe(OH)3 | C.一定有Fe3O4和Fe |
| D.一定有Fe(OH)3,可能有Fe E.只有Fe3O4 |
(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是
(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按下图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式 。
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+ 具有 性。由此可知,实验室中含Fe2+的盐溶液需现用现配制的原因是 ,并且配制含Fe2+的盐溶液时应加入少量 。
(6)乙同学为了获得持久白色的Fe(OH)2沉淀,准备用右图所示装置,用不含O2的蒸馏水配制的NaOH溶液与新制的FeSO4溶液反应。获得不含O2的蒸馏水的方法是______________。反应开始时,打开止水夹的目的是___________________________________;一段时间后,关闭止水夹,在试管_______(填“A”或“B”)中观察到白色的Fe(OH)2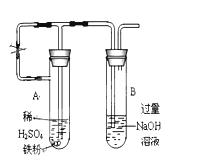
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000 mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2 mL。试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)该小组在步骤①中的错误是 ,
由此造成的测定结果 (偏高、偏低或无影响)。
(3)如图,是某次滴定时的滴定管中的液面,其读数为 mL。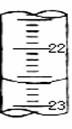
(4)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.50 |
22.60 |
| 第二次 |
20.00 |
1.00 |
24.50 |
| 第三次 |
20.00 |
2.10 |
24.00 |
请计算待测烧碱溶液的浓度为。
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子形式存在。实验室从海藻中提取碘的流程如下:
(1)指出提取碘的过程中有关实验操作的名称:
①为,③为;过程②中有关反应的离子方程式是。
(2)提取碘的过程中可供选择的有机溶剂是( )
| A.甲苯、酒精 | B.四氯化碳、苯 | C.汽油、乙酸 | D.汽油、甘油 |
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、 集气瓶、酒精灯、导管、圆底烧瓶、石棉网,以及必要的夹持装置、物品,尚缺少的玻璃仪器是。
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图所示的实验装置中的错误之处: ①,②。
(5)进行上述蒸馏操作时,使用水浴加热的原因是,最后晶态碘在里聚集。
纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业。在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。某校学生实验小组设计下图所示装置,制取该产品。D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
Ⅰ.可选用的药品有:
a.石灰石 b.饱和氯化钙溶液 c.6 mol/L盐酸 d.氯化铵 e.氢氧化钙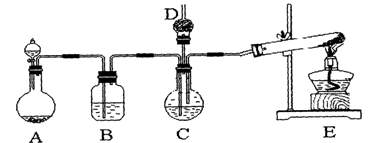
(1)A中制备气体时,所需药品是(选填字母序号);
(2)B中盛有饱和碳酸氢钠溶液,其作用是;
(3)写出制取氨气的化学方程式;
(4)在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式;
(5)检验D出口处是否有氨气逸出的方法是;
(6)写出制纳米级碳酸钙的化学方程式。
(7)若实验过程中有氨气逸出,应选用下列装置回收(填代号)。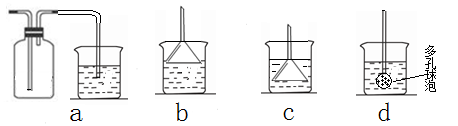
Ⅱ.经分析在上述氯化铵样品中含有杂质碳酸氢钠。为了测定氯化铵的质量分数,该学生实验小组又设计了如下实验流程: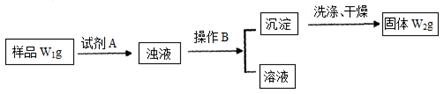
试回答:
(1)所加试剂A的化学式为
(2)B操作方法是
(3)样品中氯化铵的质量分数为。
如图是苯和溴的取代反应的实验装置图,其中A为具有支管的试管 , 改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量的铁屑粉.填写下列空白: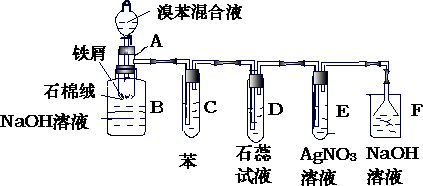
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应.写出A中发生反应的化学方程式(有机物写结构简式)。
(2)试管C中苯的作用是.反应开始后,观察D和E两试管,看到的现象是。
(3)反应2min~3min后,在B中的氢氧化钠溶液里可观察到的现象是。
(4)在上述整套装置中,具有防倒吸作用的仪器有。
(5)改进后的实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这三个优点外,还有一个优点是: 。
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下: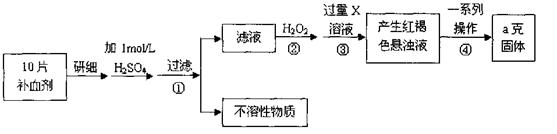
请回答下列问题:
(1)步骤①滤液中滴加KSCN溶液后滤液变为红色,则该溶液中含有 (填离子符号),检验滤液中还存在Fe2+的方法为
(注明试剂、现象)。
(2)步骤②加入过量H2O2的目的是 。
(3)步骤③中反应的离子方程式为 。
(4)步骤④中一系列处理的操作步骤包括:过滤、 、灼烧、 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量为 g。