强酸和强碱的稀溶液的中和热可表示为:H+(aq)+OH-(aq)=H2O(1) △H = -57.3kJ/mol
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(1) △H ="-" Q1kJ/mol
1/2 H2SO4(aq) + NaOH(aq) ="=" 1/2Na2SO4(aq) +H2O(1) △H ="-" Q2kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1) △H ="-" Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为( )
| A.Q1=Q2=Q3 | B.Q2>Q1>Q3 | C.Q2>Q3>Q1 | D.Q2=Q3>Q1 |
已知反应:①101kPa时,C(s) + 1/2O2(g)=CO(g) △H1=-110.5kJ/mol
②稀溶液中,H+(aq) + OH-(aq)=H2O(1) △H2=-57.3kJ/mol
下列结论正确的是()
| A.若碳的燃烧热用△H3来表示,则△H3<△H1 |
| B.若碳的燃烧热用△H3来表示,则△H3>△H1 |
| C.浓硫酸与稀NaOH溶液反应的中和热为57.3kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |
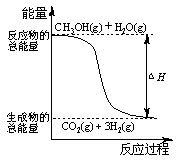
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ/mol
下列说法错误的是
| A.1mol CH3OH(g)完全燃烧放出的热量大于192.9 kJ |
| B.根据反应①和②推知反应: H2(g)+1/2O2(g)=H2O(g)的△H=-241.9kJ/mol |
| C.CH3OH转变成H2的过程不一定要吸收能量 |
| D.反应①中的能量变化如图所示 |
广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果都是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述观点,下列说法中不正确的是
A.CaO2的水解产物是Ca(OH)2和H2O2 |
B.Al4C3的水解产物是Al(OH)3和甲烷 |
C.PCl3的水解产物是PH3和HClO  |
D.A1(C2H5)3的水解产物是Al(OH)3与C2H6 |
主链含5个碳原子,有甲基、乙基2个支链的烷烃有
| A.2种 | B.3种 | C.4种 | D.5种 |
常温下,下列各组离子在指定溶液中可能大量共存的是
| A.由水电离的c(H+)=10-12mol·L-1的溶液中:Cl-、CO32-、K+、SO32- |
| B.含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3- |
| C.1.0mol·L-1的KNO3溶液:H+、Fe2+、Cl—、SO42— |
| D.使pH试纸变深蓝色的溶液中:Cl-、K+、Mg2+、SO32- |