根据分散剂和分散质的状态不同可以组成( )种分散系
| A.3 | B.11 | C.9 | D.6 |
某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。充放电时的电池反应为:Li+LiMn2O4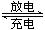 Li2Mn2O4。下列说法正确的是
Li2Mn2O4。下列说法正确的是
| A.放电时,LiMn2O4发生氧化反应 |
| B.放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4 |
| C.充电时,LiMn2O4发生氧化反应 |
| D.充电时,阳极反应为:Li++e-==Li |
下图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol e-,若不考虑溶液体积的变化,则下列叙述正确的是
| A.在①中溶液的Cu2+向铜棒移动 |
| B.电极上析出物质的质量:①<② |
| C.电极反应式:①中阳极:4OH一一4e一= 2H2O+O2↑;②中负极:2H+ + 2e一= H2↑ |
| D.溶液的pH:①不变;②增大 |
下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应:
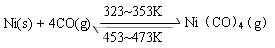
但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是
| A.纯Ni(s)和Ni(CO)4(g) | B.纯Ni(s)和CO(g) |
| C.不纯Ni(s)和CO(g) | D.不纯Ni(s)和Ni(CO)4(g) |
食品包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
| A.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
| B.脱氧过程中铁作原电池负极,电极反应为:Fe-3e-=Fe3+ |
| C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH- |
| D.加入脱氧剂的目的是因为该反应是吸热过程,可降低温度,延长食品保质期 |
下列有关电化学的图示,完全正确的是