现有甲、乙、丙、丁和Fe(OH)3五种胶体溶液,按甲和丙、乙和丁、丙和乙、乙和Fe(OH)3胶体两两混合,均出现胶体凝聚,则胶体微粒带负电荷的胶体溶液是 。
关于银镜反应的实验操作步骤如下:
| A.在试管中先注入少量NaOH溶液,振荡,加热煮沸之后把NaOH溶液倒去,再用蒸馏水洗净试管备用. |
| B.在洗净的试管里配制银氨溶液. |
| C.向银氨溶液中滴入3~4滴乙醛稀溶液. |
| D.加热. |
请回答下列问题:
(1)步骤A中加NaOH溶液振荡,加热煮沸的目的是_____________________________
________________________________________________________________________.
(2)简述银氨溶液的配制过程:__________________________________________
________________________________________________________________________.
(3)写出乙醛发生银镜反应的化学方程式:_____________________________________
________________________________________________________________________.
(4)银氨溶液久置可能会爆炸,直接排放会污染环境,且造成资源浪费,实验室从废液中回收银的实验流程如
已知:[Ag(NH3)2]+ Ag++2NH3
Ag++2NH3
①写出废液与稀硝酸反应的离子方程式:__________________________________
________________________________________________________________________.
②加入铁粉要过量的目的是___________________________________________.
③该实验过程中可能产生的大气污染物是________________________________.
有A、B、C三种烃的衍生物,相互转化关系如下: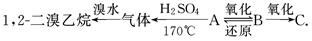
其中B可发生银镜反应,C跟石灰石反应产生能使澄清石灰水变浑浊的气体.
(1)A、B、C的结构简式和名称依次是______________________________________、
________________、________________.
(2)写出下列反应的化学方程式.
①A→B的化学方程式为:_____________________________________________.
②B→C的化学方程式为:_______________________________________________.
③B→A的化学方程式为:______________________________________________.
下图中硬质试管A中放入干燥洁净的细铜丝,烧杯中放入温水,试管B中放入甲醇,右方试管C中放入冷水.向B中不断鼓入空气,使甲醇蒸气和空气通过加热到红热程度的铜丝.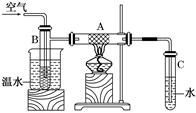
(1)撤去A处酒精灯后铜丝仍然能保持红热的原因是
________________________________________________________________________.
(2)反应后将试管C中的液体冷却,取出少量,加入到新制的Cu(OH)2悬浊液中,加热到沸腾可观察到现象是____________.写出反应的化学方程式_____________________.
A和B两种物质的分子式都是C7H8O,它们都能跟金属钠反应放出氢气.A不溶于NaOH溶液,而B能溶于NaOH溶液.B能使适量溴水褪色,并产生白色沉淀,A不能.B苯环的一溴代物有两种结构.
(1)写出A和B的结构简式.
A:__________________;B.________________.
(2)写出B与NaOH溶液起反应的化学方程式:
________________________________________________________________________.
为了确定CH3COOH、 及H2CO3的酸性强弱,有人设计了如图所示的装置进行实验:
及H2CO3的酸性强弱,有人设计了如图所示的装置进行实验: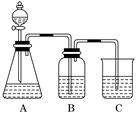
(1)若锥形瓶中装有一种易溶于水的正盐固体,则A中发生反应的离子方程式为________________________________________________________________________.
(2)装置B中盛放的试剂是________,它的作用是___________________________
______________________________________________________________________.
(3)实验中观察到C中出现的主要现象是_________________________________
________________________________________________________________________.