在下列条件下能否发生离子反应?对能发生的写出离子方程式,不能发生的说明理由
(1)CH3COONa溶液与HCl溶液混和_________________________
(2)Ca(OH)2的澄清溶液与Na2SO4稀溶液混和____________________
(3)Ca(OH)2的澄悬浊液与Na2SO4浓溶液混和____________________
(4)CuCl2溶液与H2SO4溶液混和__________________________
硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(1)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:_____________。
(2)该反应中发生氧化反应的物质是__________,1 mol氧化剂_________(填“得到”或“失去”)_______ mol电子。
(3)48.0 g Cu与适量的浓HNO3反应,铜全部作用后,共收集到22.4 L气体(标准状况下),反应中消耗HNO3的物质的量可能是()
A.1.5 mol B.2.0 mol C.2.5 mol D.3.0 mol
(4)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等。请将3种物质: FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
HNO3+ ______  ______+ ______ + N2O↑ + H2O
______+ ______ + N2O↑ + H2O
并写出配平后的离子方程式:_________________________。
(5)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念——“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是()
A.Cu  Cu(NO3)2
Cu(NO3)2
B.Cu  CuO
CuO Cu(NO3)2
Cu(NO3)2
C.Cu  CuO
CuO Cu(OH)2
Cu(OH)2 Cu(NO3)2
Cu(NO3)2
D.Cu CuSO4
CuSO4 Cu(NO3)2
Cu(NO3)2
实验室里常用的干燥剂有:①生石灰,②固体氢氧化钠,③变色硅胶[主要成分是二氧化硅,在其中掺入少量的无水氯化钴(CoCl2)作指示剂],④五氧化二磷,⑤无水氯化钙,⑥浓硫酸,⑦碱石灰(主要成分是氢氧化钠、氧化钙)等。
(1)上述物质中,属于纯净物的是__________。
A.①②④ B.②④⑥ C.①②④⑤ D.全部
(2)上述②、④、⑤、⑥四种干燥剂中,其主要化学成分所属的类别依次为______、________、________、______。(填序号)
A.酸 B.碱 C.盐D.氧化物
(3)硅胶中无水氯化钴(CoCl2)呈蓝色,吸水后变为粉红色的CoCl2•6H2O,该变化过程属于____________(填“物理变化”或“化学变化”)。
(4)下列气体中,能用固体氢氧化钠干燥的是()
A.CO2 B.HCl C.NO2 D.NH3 E.NO
(5)生石灰常用作食品干燥剂,久置后易失去干燥能力,其原因为_________________ (用化学方程式表示)
(6)上述干燥剂中,仅有浓硫酸为液体干燥剂,下列关于浓硫酸的叙述正确的是()
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸为液体干燥剂,干燥效率高,能用于干燥所有的气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化: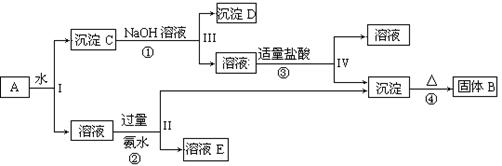
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是。
(2)根据上述框图反应关系,写出下列B、 D所含物质的化学式
固体B;沉淀D。
(3)写出①、②反应的离子方程式:
①;②;
(4)以Fe2O3为原料,可制备FeCl2溶液,请写出有关的化学反应方程式,试剂任选。
Ⅰ.小苏打是某种治疗胃酸过多的胃药的主要成分,请写出该反应的离子方程式:。
Ⅱ.氨气通入水中可制得氨水,氨水能使无色的酚酞变红。请写出实验室制取氨气的化学方程式:,
检验氨气的一种化学方法是:。
Ⅲ.火药是中国的“四大发明”之一,黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S=K2S+2NO2↑+CO2↑。其中氧化剂是;还原剂是。
M是可降解的高分子化合物,以芳香醇A为原料合成它的路线如下。
已知:

(1)写出反应Ⅰ的反应试剂和反应条件。
(2)写出反应类型。反应Ⅱ反应Ⅲ。
(3)写出结构简式。EF。
(4)写出G→M的化学反应方程式。
(5)反应Ⅰ能否省略?;说明原因。
(6)从E→F经过两步,这两步的次序能否颠倒?;说明原因。