化学科代表小聪与小明同学帮助实验老师整理化学药品室时,发现分别放在两个试剂瓶中的两片用砂纸磨得光亮的银白色金属,未贴标签。到底它们是哪种金属?两位同学首先对这两种金属X和Y的金属活动性顺序进行实验探究。
(1)进行猜想:
①科代表小聪猜想:活动性X大于Y。
②小明同学猜想:活动性Y大于X。
(2)设计实验方案、进行实验、获得知识。完成如下实验报告,并回答后续有关问题。
| ①实验步骤 |
②实验现象 |
③结论 |
| __ __ |
金属Y表面无明显变化,金属X的表面有气泡冒出。 将燃着的木条放在装金属X的试管口,气体燃烧 |
__ 科代表小聪的猜想:_______ (“正确”或“不正确”) |
(3)上述实验之前,实验老师只知道X、Y是银铁中的各一种,则根据实验结果说明Y就是_______。实验室急需一定量的Y粉末,科代表小聪认为可用现有的X金属粉末和Y的盐溶液、蒸馏水等药品,配以必要的仪器来制得急需的Y粉末,原因是(用反应的化
学方程式表示)____________________________________。
(4)实验老师经实验分析得知制得的Y粉末中含有未反应完的X粉末,若用化学方法将杂质X粉末除去,两个同学经讨论、交流一致认为可选用的除杂质试剂是_________。
小立在家洗衣服时,发现一瓶刚过期的漂白液,对漂白液的漂白原理和该漂白液是否还有漂白作用产生了疑问。于是将其带到学校,在老师的指导下,与小组同学一起展开探究。
【查阅资料】
①制取漂白液的原理:Cl2+2NaOH=NaClO+NaCl+H2O,起有效成分是NaClO;
②漂白液的漂白原理:
NaClO在空气中很快发生反应:2NaClO+H2O+CO2=Na2CO3+2HClO
生成的HClO能使有色布条(含有机色素)褪色;
③HClO不稳定,易分解,分解后丧失漂白作用。
【提出问题】刚过期的漂白液是否失效?
【实验探究】该小组的实验报告如下:
| 实验操作 |
实验现象 |
实验结论 |
| 取适量该漂白液与烧杯中, |
该漂白液已完全失效 |
小组同学对失效后漂白液的主要成分很感兴趣,纷纷提出猜想并作进一步探究。
【提出猜想】小立猜想有:NaCL
小英猜想有:NaCl、Na2CO3
小洁猜想有:NaCl、Na2CO3、NaOH
【设计方案】
小组同学经过讨论,认为用足量的稀盐酸就可以验证的猜想成立。
为验证另两位同学的猜想,他们设计了如下方案:
| 实验步骤 |
预期实验现象 |
实验目的或预期结论 |
| 步骤①;取少量该漂白液于试管中,加 入,静置,观察 |
产生白色沉淀 |
目的: |
| 步骤②:取上层清液于试管中, ,观察 |
结论:猜想成立;否则,另一位同学猜想成立。 |
最后,他们综合小组同学的设计,经实验得出了结论。
化学小组同学在加热二氧化锰样品时,发现有气泡产生(如图一所示),于是他们对这个异常现象进行了探究。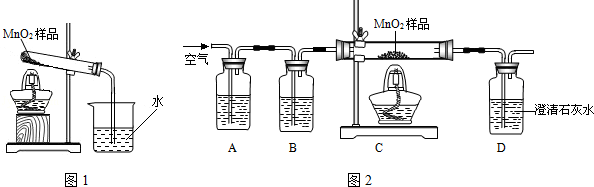
(1)对气体成分的探究:加热二氧化锰样品,用燃着的木条靠近试管口,木条熄灭。将气体通入澄清的石灰水,发现石灰水变浑浊,产生的气体是。
(2)对气体来源的探究:
甲同学认为:该气体来自于试管中的空气,请你设计实验证明该假设不成立
| 实验步骤及现象 |
结论 |
| 加热空的试管,另一端的澄清石灰水没有变浑浊 |
假设(填“不成立”或“成立”) |
乙同学认为:二氧化锰样品中可能混有炭粉,炭粉发生反应生成了该气体。他设计了如图二所示的实验进行研究,其中B装置的作用是检验A中反应是否完全,B中的试剂是,实验中观察到D处澄清石灰水变浑浊。他又用氮气代替空气(氮气不参与该实验中的任何反应),重复上述实验,发现D处澄清的石灰水也变浑浊。通过乙同学的实验证明,二氧化锰中混有炭粉,炭粉与反应产生了这种气体。
为了提高实验探究能力,老师为同学们提供了一包白色粉末,它可能是碳酸钙、氢氧化钙或两种物质的混合物。
(1)同学们设计了以下三种实验方案:
方案Ⅰ:取样品加入试管中,滴加稀盐酸,有气泡产生则白色粉末是碳酸钙。
方案Ⅱ:取样品加入试管中,滴加稀盐酸,无气泡产生则白色粉末是氢氧化钙。
方案Ⅲ:取样品加入试管中,加水振荡,静置,下层有不溶物,上层清液中滴入酚酞溶液,溶液变红,则白色粉末是碳酸钙和氢氧化钙的混合物。
以上三种方案中,你认为不合理的是(填方案序号),其不合理的理由是。
(2)请再设计一种方案,证明该粉末是两种物质的混合物,简要写出实验的操作、现象及结论。
| 操作步骤 |
实验现象及结论 |
在学校的元旦联欢会上,某同学表演了“水能生火”的魔术。他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来。小蔡很感兴趣,于是,他和同学们进行探究。
提出问题:过氧化钠与水反应生成了什么物质?为什么脱脂棉会燃烧?
猜想:①可能有一种气体和另一种物质生成
②反应过程中可能有热量放出
设计装置如图所示
实验探究:实验一:探究反应后生成的气体是什么?
(1)打开上图装置中分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃,说明生成的气体是。
(2)实验中,还观察到伸入烧杯中的导管口有气泡冒出,请解释产生该现象的原因:。
实验二:继续探究反应后生成的另一种物质是什么?
(1)小张猜想另一种物质是Na2CO3,小蔡认为不可能.小蔡的依据是:。
(2)小蔡取反应后所得的溶液于试管中,滴入无色酚酞试液,发现酚酞试液变红色,说明反应后所得的溶液呈性。
表达:由实验探究的结果,写出过氧化钠和水反应的化学方程式。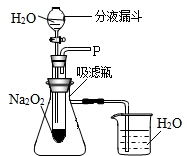
某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品,反应的化学方程式为:
2NaCl+2H2O 2NaOH+H2↑+Cl2↑。某研究性学习兴趣小组对该厂生产的烧碱样品进行如下探究。
2NaOH+H2↑+Cl2↑。某研究性学习兴趣小组对该厂生产的烧碱样品进行如下探究。
[提出问题]:烧碱样品中含有哪些杂质?
[猜想]:
(1)可能含有NaCl,作出此猜想的依据是电解的过程中氯化钠没有完全反应。
(2)可能含有碳酸钠,做出此猜想的理由是(用化学方程式表示)。
[实验设计]
| 实验步骤 |
实验现象 |
解释或结论 |
| ①取适量的烧碱样品置于试管中加水溶解,用手触摸试管外壁。 |
试管外壁发热。 |
原因是 |
| ②向①所得的溶液中加入盐酸至过量。 |
开始时无明显现象,过一段时间后有气泡产生。 |
说明样品中含有杂质 |
| ③向②所得的溶液中加入硝酸银溶液。 |
有白色沉淀产生。 |
AgNO3+NaCl=AgCl↓+NaNO3 说明样品中含有杂质氯化钠 |
[反思]:小明认为上述实验不能说明样品中含有氯化钠,理由是。