某温度下,一定量的混合气体在密闭容器中发生如下反应:mA(气)+nB(气) pC(气)达平衡后,将气体体积缩小到原来的
pC(气)达平衡后,将气体体积缩小到原来的 ,当达到新平衡时,C的浓度为原来的1.9倍,其压缩过程中保持温度不变,则反应方程式中两边系数关系是: 。
,当达到新平衡时,C的浓度为原来的1.9倍,其压缩过程中保持温度不变,则反应方程式中两边系数关系是: 。
烃A在一定条件下可以按下图进行转化: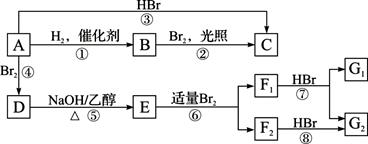
已知D为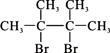 ,F1和F2互为同分异构体,加成HBr时F1有两种加成产物,F2只有一种加成产物,G1和G2分别互为同分异构体。据此作答:
,F1和F2互为同分异构体,加成HBr时F1有两种加成产物,F2只有一种加成产物,G1和G2分别互为同分异构体。据此作答:
(1)框图中属于取代反应的是_________(填序号);B完全燃烧后生成的CO2和水的质量比为_________。
(2)A的结构简式是_________________;G1的结构简式是____________________。
(3)写出E在一定条件下生成高聚物的化学方程式:____________________
乙酸异戊酯(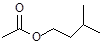 )是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图(有关的加热和夹持仪器略去)和有关数据如下:
)是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图(有关的加热和夹持仪器略去)和有关数据如下:
实验步骤:在烧瓶中加入4.4 g的异戊醇,6.0 g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热烧瓶,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁晶体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。回答下列问题:
| 相对分子质量 |
密度/(g·cm-3) |
沸点/℃ |
水中溶解性 |
|
| 异戊醇 |
88 |
0.8123 |
131 |
微溶 |
| 乙酸 |
60 |
1.0492 |
118 |
溶 |
| 乙酸异戊酯 |
130 |
0.8670 |
142 |
难溶 |
(1)写出制取乙酸异戊酯的化学方程式 。
(2)冷凝管的作用是,碎瓷片的作用是 。
(3)若乙酸异戊酯产率偏低,其原因可能是 。
A.原料没有充分反应
B.发生了副反应
C.在进行蒸馏纯化操作时,从143 ℃开始收集馏分
(4)在洗涤、分液操作中,应充分振荡,然后静置,待分层后 (填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(5)实验中加入少量无水硫酸镁的目的是 。
(6)本实验的产率是
A.30℅ B.40℅ C.50℅ D.60℅
从樟科植物枝叶提取的精油中含有甲、乙两种成分: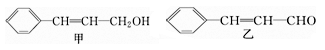
(1)①用酸性高锰酸钾溶液检验甲和乙中含有碳碳双键,方案是否可行(填“可行”或“不可行”)。
②请写出甲的一种能同时满足下列3个条件的同分异构体的结构简式 。
a.苯环上有两个不同的取代基
b.能与Br2的CCl4溶液发生加成反应
c.遇FeCl3溶液呈现紫色
(2)由甲转化为乙的过程为(已略去无关产物):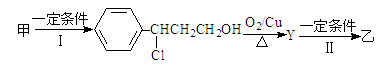
步骤Ⅰ的反应类型为 ,Y的结构简式 ,设计步骤Ⅰ的目的是 。
(3)1 mol乙最多可与 mol H2发生加成反应。
(4)写出乙与新制Cu(OH)2悬浊液反应的化学方程式 。
碳酸二甲酯(DMC)是一种低毒性的绿色化学品,可用于代替高毒性的光气(COCl2)作羰基化试剂。DMC的合成路线如下图。完成下列填空。
已知: RCO-OR1 + R2O-H→RCO-OR2 + R1O-H(称酯交换反应)
(1)写出反应类型:反应①________ ;反应③ _________ ;
(2)写出结构简式:DMC__________;X___________;
(3)已知物质Y与DMC互为同分异构体,Y的水溶液呈酸性,在一定条件下2 molY能生成1mol分子中含六元环结构的有机物Z,则Y的结构简式为________,Z的结构简式为________;
(4)DMC与双酚( )在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:_______________________。
)在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:_______________________。
聚己二酸丙二酯(PPA)的一种合成路线如下:
已知;
①烃A的相对分子质量为84,核磁共振氢谱显示只有一种化学环境的氢
②化合物B为单氯代烃;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质
回答下列问题:
(1)A的结构简式为______________。
(2)由B生成C的化学方程式为______________。
(3)由E和F生成G的反应类型为______________。
(4)①由D和H生成PPA的化学方程式为______________。
②若PPA平均相对分子质量为11000,则其平均聚合度约为______________。
a.48 b.59 c.75 d.102
(5)在D的同分异构体中,能发生银镜反应,核磁共振谱显示为4组峰,且峰面积比为2:1:1:1的是______(写结构简式)
(6)D的所有同分异构在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是__________。
a、质谱仪 b、红外光谱仪 c、元素分析仪 d、核磁共振仪