现有含NaCl、Na2SO4、Na2CO3和NaHCO3的固体混合物。某同学为测定其中各组分的含量,取部分样品溶于水,并设计了如下实验流程(所加试剂均为过量,反应①~③均为复分解反应)。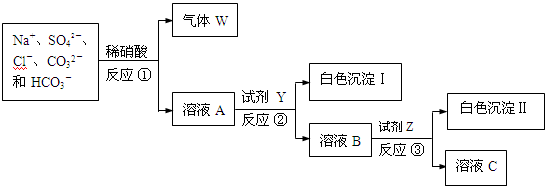
请回答: (1)气体W的化学式是 。
(1)气体W的化学式是 。
(2) 溶液A中主要存在的微粒除了Na+、SO42-、Cl-之外还有 。
溶液A中主要存在的微粒除了Na+、SO42-、Cl-之外还有 。
(3)反应②和③之后均需进行的操作的名称是 。
(4)试剂Y是 (填化学式)。
(5)测定各组分的含量,需要测的数据有:混合物总质量、白色沉淀Ⅰ和Ⅱ分别的质量和 。
某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:
(1)请写出Fe2O3与①反应的离子方程式______________________________。
(2)物质②为_______________。
(3)请写出FeCl3与铁粉反应的化学方程式________________________。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为_________,此过程中发生的氧化还原反应为(用化学方程式表达)________________________。
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③__________________,它与FeCl3溶液、Fe(OH)3浊液的本质区别是__________ ______。
实验证明铜在低温下不能和O 2 发生反应,也不能和稀H 2 SO 4 共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并不断通入空气来制取CuSO 4 溶液的,铜屑在此状态下发生的一系列化学反应为:______________,______________。利用铜和浓H 2 SO 4 在加热条件下也能制备CuSO 4 溶液,其化学方程式为______________。以上方法前者好还是后者好?原因是什么?_____________________
某同学欲检验抗酸药中是否含有Al(OH)3,操作如下:取药剂3~4片研碎,向样品中加入过量的盐酸,过滤,得澄清溶液,向澄清溶液中滴加NaOH溶液,观察到有白色沉淀,继续加过量NaOH溶液,白色沉淀又溶解。你能得出该抗酸药中____________(填“含”或“不含”)有Al(OH)3,请写出有关反应的化学方程式:
(1)______________________________;
(2)______________________________;
(3)______________________________。
将还原性铁粉分别放入冷的浓H2 SO4 、浓HNO3 中,开始都有大量气泡生成,后来反应不再发生。已知生成的气体有刺激性气味,H2 SO4 中生成的气体呈无色,HNO3 中生成的气体呈红棕色;剩余的固体经检验有磁性。试回答:
(1)Fe的氧化产物是____________。(写化学式,下同)
(2)浓H2SO4的还原产物是____________,浓HNO3的还原产物是____________。
有一瓶无色气体,可能含H2S、CO2、HCl、HBr、SO2中的一种或几种。将其通入氯水中,得无色透明溶液,将这种溶液分为两份,向一份中加入用盐酸酸化的BaCl2溶液,出现了白色沉淀;向另一份中加入用硝酸酸化的AgNO3溶液,产生了白色沉淀。据此推断:肯定有__________,肯定没有__________,无法确定的是__________。