图是某化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图。在烧瓶A中放一些新制的无水硫酸铜粉末,并加入约20 mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中分别盛浓硫酸;干燥管F中填满碱石灰;烧杯作水浴器。当打开分液漏斗的活塞后,由于浓硫酸流入B中,则D中导管口有气泡产生。此时水浴加热,发生化学反应。过几分钟,无水硫酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出。试回答:
(1)B逸出的主要气体名称__________;(2)D瓶的作用是___________________;
(3)E管的作用是___________;(4)F管口点燃的气体分子式__________________。
(5)A瓶中无水硫酸铜粉末变蓝的原因是_______;(6)A中发生的方程式: 。
(本题共12分)元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
23.与氯元素同族的短周期元素的原子,其核外能量最高的电子所处的电子亚层是;
24.碘元素在元素周期表中的位置是;为防缺碘,食盐中常添加碘酸钾,该物质内存在键(填化学键类型)。
25.溴单质是唯一常温下呈液态的非金属单质,它的电子式是;液溴的保存通常采取的方法是。
26.通过比较___________或________________可以判断氯、溴两种元素非金属性强弱。
27.工业上,通过如下转化可制得KClO3晶体: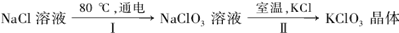
①配平I中反应的总化学方程式,并标出电子转移的方向和数目:
□NaCl + □H2O 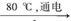 □NaClO3+ □
□NaClO3+ □
②II反应过程能析出KClO3晶体而无其它晶体析出的原因是。
28.CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是_________________________。
(本题共12分)
某酯(H)是一种合成多环化合物的中间体,可由下列路线合成(部分反应条件略去): 
49.A→B的反应类型是________,B→C为加成反应,则化合物M的结构简式是____________;
50.H中除了羰基(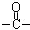 )外,含有的官能团名称是_______________;
)外,含有的官能团名称是_______________;
51.E→ F的化学方程式是__________________________________;
52.TMOB是H的同分异构体,具有下列结构特征:①核磁共振氢谱表明,分子中除苯环外,其它氢原子化学环境相同;②存在甲氧基(CH3O—)。TMOB的结构简式是_______________;
53.下列说法正确的是
| A.D和F中均属于炔烃类物质 |
| B.A能和HCl反应得到聚氯乙烯的单体 |
| C.1mol G完全燃烧生成7mol H2O |
| D.H能发生加成、取代反应 |
(本题共10分)3-对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下: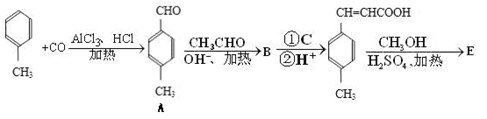
已知:HCHO+CH3CHO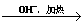 CH2=CHCHO+H2O。
CH2=CHCHO+H2O。
45.A的同分异构体有多种,写出其中遇FeCl3溶液显紫色且苯环上有两个取代基的有机物结构简式____ 。B中含氧官能团的名称为_____________。
46.试剂C可选用下列中的_____________。
| A.溴水 | B.银氨溶液 |
| C.酸性KMnO4溶液 | D.新制Cu(OH)2悬浊液 |
47.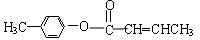 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为_________________________________________________________。
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为_________________________________________________________。
48.E在一定条件下可以生成高聚物F,F的结构简式为______________________________________。
(本题共12分)大约100年前,德国化学家哈伯(F.Haber)开始研究由氮气和氢气合成氨。一种工业合成氨的简易流程图如下: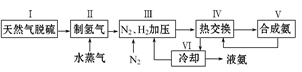
28.天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___________________________________________。
29.工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化含某些杂质的原料氢气。已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27。R原子核外电子有_____种不同运动状态,最外层的p电子有_______种自旋方向。
30.常温下,不能与M单质发生反应的是_________(填序号)
A.CuSO4溶液
B.Fe2O3
C.浓硫酸
D.NaOH溶液
E.Na2CO3固体
步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g) CO(g)+3H2(g)- 206.4 kJ
CO(g)+3H2(g)- 206.4 kJ
②CO(g)+H2O(g) CO2(g)+H2(g)+ 41.2 kJ
CO2(g)+H2(g)+ 41.2 kJ
31.对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是。
A.升高温度B.增大水蒸气浓度 C.加入催化剂 D.降低压强
32.利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为__________。
33.依据温度对合成氨反应的影响,在下图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
(本题共12分)磷单质及其化合物在工业生产中有着广泛的应用。白磷可用于制备高纯度的磷酸(磷酸结构式为 ),次磷酸钠(NaH2PO2)可用于化学镀镍等等。
),次磷酸钠(NaH2PO2)可用于化学镀镍等等。
完成下列填空:
23.NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为____________。
24.写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式______。
25.磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。其水溶液呈酸性的原因是_______________________________________________________。(请用文字描述)
26.已知磷酸分子中的三个氢原子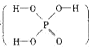 都可以跟重水分子(D2O)中的D原子发生氢交换。 又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是
都可以跟重水分子(D2O)中的D原子发生氢交换。 又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是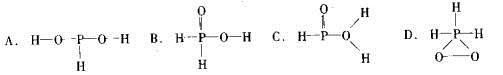
27.次磷酸钠(NaH2PO2)可用于化学镀镍。化学镀镍的溶液中含有Ni2+和H2PO2-,在一定条件下能发生如下反应:__Ni2++__H2PO2-+ →__Ni + ___H2PO3-+_____。请完成并配平上述反应离子方程式。该反应的还原产物是__________,反应中转移1摩尔电子时,理论上产生金属镍______克。