石油主要由烷烃、环烷烃和各种芳香烃组成,石油通过分馏、裂化可得直馏汽油和裂化汽油。现有直馏汽油和裂化汽油各一瓶。
(1)请从下列试剂中选择最合理的试剂予以区别。所选试剂是 。
A.KMn04(H+)溶液 B.乙醇 C.溴水
(2)加入所选试剂后,直馏汽油中观察到的现象是 ;裂化汽油
中观察得到现象是 。
PM2.5污染跟工业燃煤密切相关,燃煤还同时排放大量的SO2和NOX。
(1)在一定条件下,SO2气体可被氧气氧化,每生成8 g SO3气体,放出9.83 kJ的热量,写出该反应的热化学方程式。若起始时向密闭容器内充入0.4molSO2和0.2mol O2,达平衡后放出的热量为Q,则Q39.32kJ(填“>”、“<”或“=”).
(2)一定条件下,在恒容密闭的容器中,当上述反应达到平衡时,下列说法正确的是__________(填序号)
a.2v逆(SO2)=v正(O2)
b.ΔH保持不变
c.混合气体密度保持不变
d.混合气体的平均相对分子质量保持不变
(3)500℃时,在催化剂存在条件下,分别将2 mol SO2和1 mol O2置于恒压容器I和恒容容器II中(两容器起始容积相同,),充分反应均达到平衡后,两容器中SO2的转化率关系是I_________II(填“>”、“<”或“=”)。若测得容器II中的压强减小了30%,则该容器中SO3体积分数为(结果保留3位有效数字)。
(4)将生成的SO3溶于水,再向溶液中通入NH3得到1L cmol/L(NH4)2SO4溶液的PH=5,计算该(NH4)2SO4溶液的水解平衡常数Kh=。
(5)NO2、O2和熔融NaNO3可制作原电池,其装置见下图。该电池中Na+向_____电极移动(填“Ⅰ”或“Ⅱ”),在电池使用过程中石墨I电极上生成氧化物Y,其电极反应为。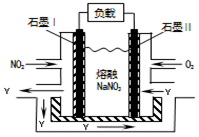
(1)已知:①CO(g)+2H2(g) CH3OH(g)△Hl= -91kJ·mol-l
CH3OH(g)△Hl= -91kJ·mol-l
②2CH3OH(g) CH3OCH3(g)+H2O(g)△H2= -24 kJ·mol-1
CH3OCH3(g)+H2O(g)△H2= -24 kJ·mol-1
③CO(g) +H2O(g)  CO2(g)+H2(g)△H3= -41 kJ·mol-l
CO2(g)+H2(g)△H3= -41 kJ·mol-l
且三个反应的平衡常数依次为K1、K2、K3
则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g)△H=
CH3OCH3(g) +CO2(g)△H=
化学平衡常数K=(用含K1、K2、K3的代数式表示)。
(2)写出反应②2CH3OH(g)  CH3OCH3(g)+H2O(g)平衡常数的表达式Kc=
CH3OCH3(g)+H2O(g)平衡常数的表达式Kc=
若在某温度下的平衡常数Kc = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| c /mol·L-1 |
0.44 |
0.60 |
0.60 |
此时,v (正) _____ v (逆) (填“>”、“<”或“=”)。
某二元酸 H2A 的电离方程式是:H2A=H++HA-,HA-  A2-+H+。回答下列问题:
A2-+H+。回答下列问题:
(1)H2A是(填“强电解质”或“弱电解质”或“非电解质”)
(2)NaHA 溶液显(填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示);
(3)若 0.1mol·L-1NaHA 溶液的 pH=2,则 0.1mol·L-1 H2A溶液中氢离子的物质的量浓度可能0.11mol·L(填“<”、“>”或“=”);
(4)0.1mol·L NaHA溶液中各离子浓度由大到小的顺序是。
设计出燃料电池使天然气CH4氧化直接产生电流是对世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入天然气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。回答如下问题:
(1)这个电池的正极发生的反应是:;
(2)固体电解质里的O2-向极(填“正”或“负”);
(3)天然气燃料电池最大的障碍是氧化反应不完全,产生堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年时间,正是新一代化学家的历史使命。
(4)若将此甲烷燃料电池设计成在25%的KOH溶液中的电极反应,该电池的负极区域的碱性会_______(填“增强”、“减弱”或“不变”)。
(10 分)T℃时,将3mol气体A和1mol气体B通入体积为2L的密闭容器内,发生反应:3A(g)+B(g) xC(g) ,2min后反应达到平衡状态(温度不变),剩余0.8molB。并测得C的浓度为0.4 mol / L.请回答下列问题:
xC(g) ,2min后反应达到平衡状态(温度不变),剩余0.8molB。并测得C的浓度为0.4 mol / L.请回答下列问题:
(1)从开始反应至平衡状态,生成C的平均反应速率为,A的转化率为。
(2)x=。
(3)判断该反应达到平衡状态的依据是(填字母)。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.混合气体的平均分子质量不随时间改变
(4)T ℃时,向2L密闭容器中再充入4molC,反应xC(g) 3A(g)+B(g)达到平衡时,化学平衡常数K= 。
3A(g)+B(g)达到平衡时,化学平衡常数K= 。