钛被誉为“亲生物金属”,可以用来制作人造骨骼,而钛与聚氨酯树脂制作的人工心脏还利用了聚氨酯树脂良好的血液 性,而聚氨酯树脂又被称为 ,
是一种性能介于 和 的特殊材料。
某种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:
(1)此电极的正极发生的电极反应式是______________;
负极发生的电极反应式是___________________。
(2)电解液中的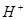 离子向____极移动;向外电路释放电子的电极是____极。(填正或负)
离子向____极移动;向外电路释放电子的电极是____极。(填正或负)
(3)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:
_______________。
(1)在BaCl2溶液中滴加Na2C2O4(草酸钠)溶液,产生白色沉淀。在白色沉淀中加入盐酸,沉淀溶解。
①试写出有关反应的离子方程式
②根据上述判断,可得出酸跟盐反应的一种规律是
(2)常温下,0.10 mol/L NH4Cl溶液pH______7(填>、=或<),溶液中各离子浓度由大到小的顺序是______________________________。
(3) Na2S溶液呈碱性的原因是________________________________(写出有关的离子方程式,下同),Al2(SO4)3溶液呈酸性的原因是_______________________________,普通泡沫灭火器是利用NaHCO3溶液跟Al2(SO4)3溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是________________________。
阿明洛芬属于苯丙酸类抗炎药,镇痛效果优于布洛芬。下图是阿明洛芬的一条合成路线。
⑴反应①为取代反应,该步反应物Me2SO4中的“Me”表示。
⑵E中的官能团有:(写名称)。
⑶写出反应类型:④;
⑷写出F的结构简式。
⑸反应③可以看成是两步反应的总反应,第一步是氰基(—CN)的完全水解反应生成羧基(—COOH), 请写出第二步反应的化学方程式。
⑹化合物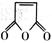 是合成某些药物的中间体。试设计合理方案由化合物
是合成某些药物的中间体。试设计合理方案由化合物 合成
合成 。
。
【提示】①合成过程中无机试剂任选;
②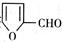 在400摄氏度金属氧化物条件下能发生脱羰基反应;
在400摄氏度金属氧化物条件下能发生脱羰基反应;
③CH2=CH-CH=CH2与溴水的加成以1,4-加成为主;
④合成反应流程图表示方法示例如下:
2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(氮化铟镓)为主。已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如右图。试回答:
(1)镓的基态原子的电子排布式是。
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为,与同一个镓原子相连的砷原子构成的空间构型为。
(3)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是。 (用氢化物分子式表示)
(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为。
(5)比较二者的第一电离能:As______Ga(填“<”、“>”或“=”)
(6)下列说法正确的是(填字母)。
A.砷化镓晶胞结构与NaCl相同 B.GaP与GaAs互为等电子体
C.电负性:As>GaD.砷化镓晶体中含有配位键
甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g)  CO(g)+3H2(g)……Ⅰ
CO(g)+3H2(g)……Ⅰ
CH4的转化率与温度、压强的关系如右图。
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为。
②图中的P1P2(填“<”、“>”或“=”),100℃时平衡常数为。
③该反应的△H0(填“<”、“>”或“=”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)  CH3OH(g);△H<0……Ⅱ。
CH3OH(g);△H<0……Ⅱ。
④若容器容积不变,下列措施可增加甲醇产率的是。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
A.则上表中剩余的实验条件数据:a="________" b=_______
B.根据反应Ⅱ的特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=_________MPa。