2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(氮化铟镓)为主。已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如右图。试回答:
(1)镓的基态原子的电子排布式是 。
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为 ,与同一个镓原子相连的砷原子构成的空间构型为 。
(3)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是 。 (用氢化物分子式表示)
(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为 。
(5)比较二者的第一电离能:As______Ga(填“<”、“>”或“=”)
(6)下列说法正确的是 (填字母)。
A.砷化镓晶胞结构与NaCl相同 B.GaP与GaAs互为等电子体
C.电负性:As>Ga D.砷化镓晶体中含有配位键
工业上,从海水中提取溴常用如下方法:
(1)将海水浓缩后,向其中通入氯气,将溴化物氧化,以溴化钠为例,用化学方程式表示该反应 ,该反应属于四种基本反应类型中的 反应,也属于
反应_______(选填“氧化还原反应”或“非氧化还原反应” )。
(2)向上述混合液中吹入热空气,将生成的溴吹出,是根据溴的沸点比水的沸点 (选填“低”或“高” )的性质,吹出的溴用碳酸钠溶液吸收,这一过程的化学方程式为3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑,生成物中溴元素的化合价分别为 价。 这一类型的化学反应称为歧化反应。
用于金属焊接的某种焊条,其药皮由大理石(CaCO3)、水泥、硅、铁等配制而成。
(1)Al的原子结构示意图为________ ___;
(2)30Si的原子的中子数为_________;
(3)可用于分离或提纯物质的方法有:①过滤 ②蒸馏 ③加热 ④分液(填序号)
除去石灰水中悬浮的大理石颗粒 。
写出下列物质的电离方程式
Na2SO4:____________________________________
Ba(OH)2:______________________________
H2SO4:_________________________________;
微粒AX2-核外有18个电子,则它的核电荷数为 ,核内中子数为 。
甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g);△H1
CH3OH(g);△H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g);△H2
CH3OH(g)+H2O(g);△H2
③CO2(g)+H2(g) CO(g)+H2O(g);△H3
CO(g)+H2O(g);△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 |
H-H |
C-O |
CO的键能 |
H-O |
C-H |
| E/(kJ.mol-1) |
436 |
343 |
1076 |
465 |
413 |
由此计算△H1= kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3= kJ.mol-1
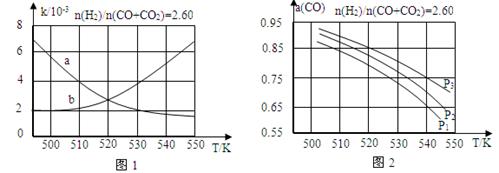
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。
|