工业上金属的冶炼过程复杂。
(1)炼铁涉及的2个热化学方程式: △H=-15.73kJ·mol-1
△H=-15.73kJ·mol-1
Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) △H= +640.4kJ·mol-1
则反应Fe2O3(s)+CO(g) = 2FeO(s)+CO2(g) 的△H= 。
(2)工业上电解硫酸锌溶液可实现湿法炼锌(控制条件,使H+难放电、阳极电极不溶解)。写出电解总方程式 。
(3)将干净的铁片浸于熔融的液态锌水中可制得镀锌钢板,这种钢板具有很强的耐腐蚀能力。镀锌钢板的镀层一旦被破坏后,锌将作为原电池的 极发生 反应。(填“氧化”或“还原”)
(4)实验室用镀锌钢板与稀硫酸制取标准状况下的氢气4.48L,则该反应转移的电子数为 ,消耗硫酸的物质的量是 。
第四周期元素的单质及化合物在工农业生产中应用广泛。
(1)第四周期元素中,基态原子的最外层只有1个电子的元素共有种。
(2)铂丝蘸取氯化钙在酒精灯上灼烧,火焰呈现砖红色,显色原因是(填序号)。
| A.氯化钙受热挥发 | B.氯化钙受热分解 |
| C.钙离子中电子跃迁 | D.氯离子中电子跃迁 |
(3)无水硫酸铜呈白色,吸水后形成胆矾,呈蓝色。科学家通过X射线测定出胆矾的结构,其结构可用右图表示。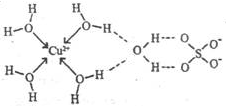
①胆矾晶体中除共价键、配位键及微弱的范德华力外,还存在的两种作用力是和。
②胆矾晶体CuSO4·5H2O可以写出[Cu(H2O)4]SO4·H2O,其中中心原子(离子)是,配体是,配位原子是,配位数是。
③铜离子形成胆矾中配位离子的离子方程式为。
(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如右表。据表判断Mn2+和Fe2+再失去-个电子的难易,并从原子结构的角度筒述其原因。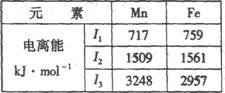
已知与碳元素同主族的X元素位于周期表中的第1个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们所形成化合物的分子式是XY4。试回答:
(1)X元素的原子基态时电子排布式为。
(2)若X、Y两元素电负性分别为2.1和2.85,则XY4中X与Y之间的化学键为(填“共价键”或“离子键”)。
(3)XY4的立体构型为,该化合物分子为(填“极性分子”或“非极性分子”)。
(4)XY4在常温下为液体,该化合物中存在的微粒间作用力有。
(5)XY4的沸点与SiCl4比较,(填化学式)的高,原因是。
已知:核电荷数小于18的三种元素X、Y、Z;X原子最外能层的p能级中有一个轨道填充了2个电子,Y原子的最外层中p能级的电子数等于前一能层电子总数,且X和Y具有相同的电子层;Z与X在周期表中位于同一主族。回答下列问题:
(1)X的价电子排布式为,Y的轨道表示式为。
(2)ZX2的分子构型为,YX2的电子式为。
(3)Y与Z形成的化合物中化学键是______键(填“极性”或“非极性”,下同),该分子属于__________分子。
(4)X的最简单氢化物中键角为,Y的最简单氢化物中中心原子是______杂化。
下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
| a |
|||||||||||||||||
| b |
c |
d |
e |
||||||||||||||
| f |
g |
||||||||||||||||
| d |
h |
[ |
|||||||||||||||
(1)请写出上述元素h的基态原子核外电子排布式;
(2)比较e、g两种元素的气态氢化物的稳定性(写化学式);
(3)b2a4分子的结构式是,该分子中存在的σ键与π键的个数比为;
(4)c、d两种元素中第一电离能较大的是(写元素符号),其原因是;
(5)已知f的氢氧化物与水电离出的OH—可形成配位键,则生成的含有配位键的离子的结构简式为(标出配位键)。
(1)按要求填空:电负性最大的元素符号 ______;第一电离能最大的元素基态原子核外电子排布式_________;第三周期原子半径最小的元素的价电子排布式______。
(2)在下列物质中:①N2、②H2O、③NaOH、④MgCl2、⑤C2H4、⑥Na2O2(用序号填空)
其中只含有非极性键的是;只含有极性键的是;只含有离子键的是;既含有非极性键又含有极性键的是;含有非极性键的离子化合物是。
(3)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,通过计算说明N2中的键更稳定(填“σ”或“π”)。