(1)按要求填空:电负性最大的元素符号 ______;第一电离能最大的元素基态原子核外电子排布式_________;第三周期原子半径最小的元素的价电子排布式______。
(2)在下列物质中:①N2、②H2O、③NaOH、④MgCl2、⑤C2H4、⑥Na2O2(用序号填空)
其中只含有非极性键的是 ;只含有极性键的是 ;只含有离子键的是 ;既含有非极性键又含有极性键的是 ;含有非极性键的离子化合物是 。
(3)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,通过计算说明N2中的 键更稳定(填“σ”或“π”)。
粗盐中除含有Ca2+、Mg2+、SO42-等可溶性杂质外,还含有泥砂等不溶性杂质。
(1)检验溶液中含有SO42-的方法是 。
(2)将粗盐溶解过滤除去不溶性杂质后,在滤液中依次滴加过量NaOH溶液、BaCl2溶液和Na2CO3溶液,直至不再产生沉淀。这些操作的目的是 , 滴加Na2CO3溶液时发生反应的化学方程式为
。
(3)用提纯后的NaCl固体配制100mL 1.0 mol/L NaCl溶液,所用仪器除托盘天平、烧杯、玻璃棒、药匙外,还需要 (填仪器名称)。转移溶液时没有洗涤烧杯会造成所配溶液浓度偏________(填“高”或“低”,下同);定容时仰视刻度线会造成所配溶液浓度偏________。
下图是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图。请认真读图分析,回答有关问题。
(1)下列叙述中正确的是(填序号) 。
| A.图中横坐标是硝酸的密度,硝酸的密度越大,其浓度越小。 |
| B.当还原剂和温度相同时,不同浓度的硝酸被还原的产物不是单一的,只是在某浓度时,以某种产物为主而已。 |
| C.硝酸的浓度越大,还原产物中N元素低化合价产物越少。 |
| D.当硝酸密度大于1.3 g·cm-3时,还原产物主要为NO、NO2 |
(2)当硝酸溶液的密度为1.36 g·cm-3时,Fe与过量硝酸反应的化学方程式是_________________。
(3)限用下列仪器、药品验证由铁和过量1.36 g·cm-3硝酸反应产生的气体中含有NO(不考虑N2O4)。设计一个合理而简单的实验方案(仪器可选择使用,N2的用量可自由控制,加热装置和固定装置省略)。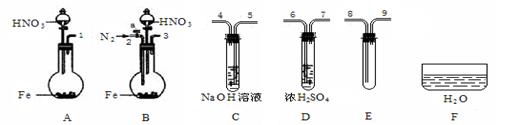
第1步:反应并收集生成的气体:
①实验中气体发生装置应选择 (填装置序号),理由是 。
②装置的连接顺序是(填各装置接口的序号):[ ]→[ ] [ ]→[8] [9]→[ ]。
③检查装置气密性后,开始反应。待E中充满红棕色气体,停止实验。
第2步:验证E中有NO。
④取下试管E,倒立在F中,轻轻摇动试管。
确认生成的气体中有NO的现象是 。
(4)某工厂生产硝酸的流程简要表示如下: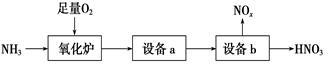
①氧化炉中反应的化学方程式为__________________________________。
②工业上通常用质量分数为15%的Na2CO3水溶液(密度1.16 g·mL-1)作为NOx吸收剂,它的物质的量浓度为_____________ mol·L-1(保留2位小数)。
含硫化合物的种类很多,现有SO2、Na2SO3、H2SO4、CuSO4四种常见的含硫化合物。
回答下列问题:
(1)将SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是 。
| A.S2- | B.S | C.SO32- | D.SO42- |
(2)亚硫酸钠中的硫呈+4价,它既有氧化性又有还原性,现有试剂:溴水、H2S、稀硫酸。请选取合适的试剂证明Na2SO3具有还原性。所选试剂是__________,该反应的离子方程式为: 。
(3)常温下,将铁棒置于浓硫酸中,无明显现象,有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面 ,则发生了钝化;若铁棒表面 ,则未发生反应。
(4)用铜制备CuSO4溶液,可设计以下三种途径:
写出途径①中反应的离子方程式 ,最佳途径是__________(填序号),理由是 。
下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。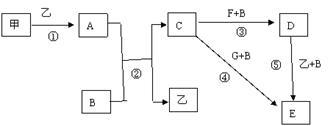
请问答下列问题:
(1)A是____________,G是______________。(填化学式)
(2)反应①-⑤中,属于氧化还原反应的是________________(填序号)。
(3)反应⑤的化学方程式为_______________________,
甲与B反应的离子方程式 _________________________。
在实验室将C溶液滴入F溶液中,观察到的现象是____________________________。
在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:_______________。
已知:酚酞在c(OH-) 为1.0×10-4mol/L~2.5mol/L时呈红色,且半分钟内不褪色。向3.9g A和100g B混合后的溶液中滴入2滴酚酞试液,溶液变红色,片刻红色褪去。(假设过程中液体体积不变)
①甲同学认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的。
上述观点是否正确 ,请通过计算对比数据加以说明____________________________。
②乙同学认为“红色迅速褪去”是由于A + B = 碱 + H2O2 ,H2O2具有氧化性和漂白性导致的。试设计简单实验证明烧瓶内溶液中含H2O2,简述实验原理 。
“材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义。请回答下列问题:
(1)无机非金属材料。高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备: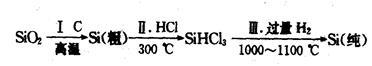
①写出步骤I的化学方程式:_______________________。
②步骤II经过冷凝得到的SiHCl3(沸点为33.0℃)中含有少量的SiCl4(沸点为57.6℃)和HCl(沸点为-84.7℃),提纯SiHCl3的实验方法是_________________。
③下列有关硅材料的说法正确的是 ( )
A.单质硅化学性质稳定,但可以被强碱溶液腐蚀
B.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
C.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
D.光导纤维的主要成分是SiO2
④在人体器官受到损伤时,需要使用一种新型无机非金属材料来植入体内,这种材料是_______(填字母)。
A.高温结构陶瓷 B.生物陶瓷 C.导电陶瓷