某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫 酸溶液进行中和热的测定。
酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)简述称量NaOH固体的操作过程:
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
(1)写出该反应的热化学方程式(中和热为57.3 kJ/mol):
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
| 温度 实验次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
30.1 |
|
| 2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
| 4 |
26.4 |
26.2 |
26.3 |
30.4 |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c="4.18" J/(g·℃)。则中和热△H = (取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
有机物A的分子式为C3H8O,它能氧化成B,也能与浓H2SO4共热生成C。 若B不能发生银镜反应,C不能使溴水褪色,分别写出A、B、C的结构简式
下列各有机化合物都有多种官能团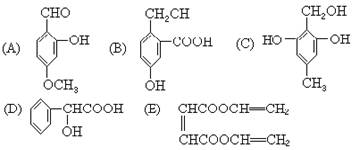
①可看作醇类的是____________________________
②可看作酚类的是____________________________
③可看作羧酸类的是__________________________
④可看作酯类的是____________________________
有机化学中取代反应的范畴很广。下列6个反应中,属于取代反应范畴的是(填写相应的字母):
簸箩酯是一种具有菠萝气味的食用香料,是化合物甲与苯氧乙酸 -O-CH2-COOH发生酯化反应的产物。
-O-CH2-COOH发生酯化反应的产物。
(1)甲一定含有的官能团的名称是_________。(1分)
(2)5.8g甲完全燃烧可产生0.3molCO2和0.3molH2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是______________________。(2分)
(3)苯氧乙酸有多种类型的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写出任意2种的结构简式)___________ _____________。(每个1分,共2分)
(4)已知: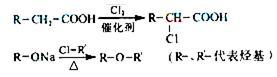
簸箩酯的合成线路如下: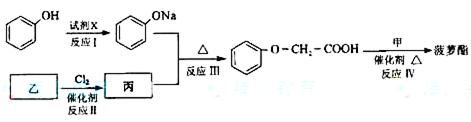
①及时X不可选用的是(选填字母)__________。(2分)
a、CH3COONa溶液 b、NaOH溶液 c、NaHCO3溶液 d、Na
②丙的结构简式是______________(2分),反应Ⅱ的反应类型是_______(1分)。
③反应Ⅳ的化学方程式是_________________________________________________。(2分)
某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了如下实验装置: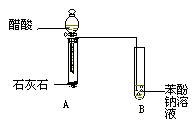
请回答下列问题
(1)仪器B中的实验现象 。
(2)仪器B中的化学方程式是 。
(3)该实验设计不严密,请改正 。