下表是几种弱酸常温下的电离平衡常数:
| CH3COOH |
H2CO3 |
H2S |
H3PO4 |
| 1.8×10-5 |
K1=4.3×10-7 K2=5.6×10-11 |
K1=9.1×10-8 K2=1.1×10-12 |
K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
(1)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看成酸,则酸性最强的是 ,最弱的是 。
(2)多元弱酸的二级电离程度远小于一级电离的原因是 。
(3)同浓度的CH3COO-、HCO3—、CO32—、S2-结合H+的能力由强到弱的顺序为 。
(4)在温度相同时,各弱酸的K值不同,K值越大酸越 (填“强”或 “弱”)。
(5)根据K值大小判断下列反应能否发生:CH3COOH + H2PO4- (填“能”或“不能”,下同) H2CO3 + HS-
(填“能”或“不能”,下同) H2CO3 + HS- 。
。

工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,具体生产流程如下: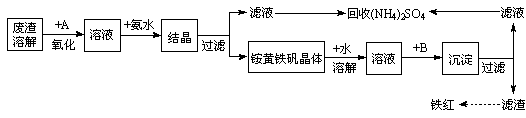
回答下列问题:
(1)在废渣溶解操作时,为了加速废渣溶解的措施是:___________________、__________________(任写两点)
(2)物质A是一种氧化剂
①工业上最好选用(填序号)
| A.空气 | B.Cl2 | C.MnO2 | D.H2O2, |
②简述工业上这样选择A的理由是、________________(任意答2条)。
③写出A参与反应的离子方程式为__________________________________________
(3根据下图有关数据,你认为工业上氧化操作时应控制的条件是__________________。
(4)往铵黄铁矾溶液(含Fe3+)中加入溶液B至pH为5时产生沉淀,请写出产生沉淀的离子方程式:_______________________________________________________。
(5)写出铵黄铁矾晶体溶于适量蒸馏水中,往其中加入过量Ba(OH)2溶液,发生反应的离子方程式为:_____________________________________________________
(6)回收所得的(NH4)2SO4晶体可能含有的杂质是:___________________________
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下: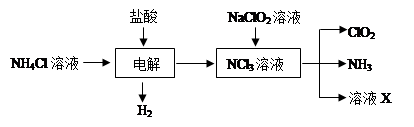
(1)除去ClO2中的NH3可选用的试剂是;可用于制取NH3的是________(填序号)
| A.饱和食盐水 | B.碱石灰 | C.浓硫酸 | D.水 E.NH4HCO3 |
(2)写出NaClO2溶液与NCl3溶液反应的化学方程式:__________________
(3)写出电解时阳极发生的电极反应式_
(4)测定ClO2的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去VmL硫代硫酸钠溶液。
①请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式
②测得ClO2的质量m(ClO2)=。(用含c、V的代数式表示)
碘及其化合物在人类活动中占有重要地位。
(1)加碘食盐中含有碘酸钾(KIO3),工业上以电解法制备碘酸钾,电解设备如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应: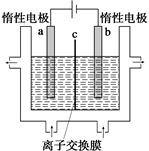
3I2+6KOH=5KI+KIO3+3H2O,再将该溶液加入(阴极、阳极)区,另将氢氧化钾溶液加入另外一个区。使用(阴、阳)离子交换膜,在阳极发生的电极反应式:。
(2)碘化氢不稳定,分解反应的热化学方程式是2HI(g)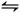 I2(g)+H2(g) ΔH="+9.48" kJ·mol-1已知ΔS>0
I2(g)+H2(g) ΔH="+9.48" kJ·mol-1已知ΔS>0
①该反应属于( )
A.任何温度均自发 B.任何温度均不自发 C.高温自发 D.低温自发
②一定条件下,反应在一个带有活塞的密闭容器中达到平衡,下列说法中不正确的是( )
A.恒温,缩小体积,平衡常数不变
B.恒温,缩小体积,平衡不移动,颜色加深
C.恒容,升温,正向反应速率和逆向反应速率均增大
D.恒容,在容器中若投入2mol HI,达到平衡时吸收9.48 kJ 的热量
③一定温度下,平衡常数K=1/4,在2L的容器中,加入4molHI发生反应达到平衡,HI的转化率。
在温度为298K时,将0.10 mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g) 2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。
2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。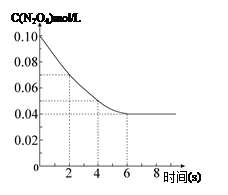
|
(1)计算在2s至4s时间内,NO2的平均生成速率为 。
(2)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到同样的平衡状态,二氧化氮的起始浓度是 mol·L-1。| T/K |
310 |
320 |
| K值 |
0.38 |
0.42 |
据此判断该反应正反应是 反应(填“吸热”或“放热”)
(6)若其他条件不变,反应在398K条件下进行并达到平衡,此温度下N2O4的浓度随时间变化的曲线(以298K条件下进行并达到平衡的曲线作为参照)正确的是 ( )
(1)家用液化石油气的主要成分之一是丁烷(C4H10),当10 kg丁烷完全燃烧并生成二氧化碳气体和液态水时,放出的热量为5×105 kJ。试写出丁烷燃烧的热化学方程式:。已知1mol液态水汽化时需要吸收44 kJ热量,则反应C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(g)的ΔH=。
(2)有同学用丁烷与空气为原料制作一燃烧电池,通入丁烷的一极为极。若以稀硫酸为电解质溶液时,其正极反应式为。
(3)已知:Fe(s) +1/2O2(g)=FeO(s)ΔH=-272.0kJ·mol-1
2Al(s)+3/2O2(g)=Al2O3(s) ΔH=-1675.7kJ·mol-1
Al和FeO发生铝热反应的热化学方程式是。
(4)已知拆开1 mol H-H键,1 molN-H键,1 molN≡N键分别需要的能量是akJ、bkJ、ckJ,则N2与H2反应生成NH3的热化学方程式为。