氧化还原反应是化学反应中的基本反应之一,研究氧化还原反应,对人类的进步具有极其重要的意义。
(1)已知:2BrO3﹣+C12=Br2+2C1O3﹣;
5C12+I2+6H2O=2HIO3+10HC1;
C1O3﹣+5C1﹣+6H+=3C12+3H2O
则C1O3﹣、BrO3﹣、IO3﹣、C12的氧化性由弱到强的排序为
(2)已知Fe3+的氧化性强于I2,请你从所给试剂中选择所需试剂,设计一个实验加以证明,(提示:请写出实验步骤、现象及结论)①FeCl3溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉溶液 ;
(3)二十世纪初期,化学家合成出极易溶于水的NaBH4.在强碱性条件下,常用NaBH4处理含Au3+的废液生成单质Au,已知,反应后硼元素以BO2﹣形式存在,反应前后硼元素化合价不变,且无气体生成,则发生反应的离子方程式为
(4)某强氧化剂[RO(OH)2]+能将Na2SO3氧化.已知含2.0×10﹣3mol[RO(OH)2]+离子的溶液,恰好跟25.0mL 0.2mol/L 的Na2SO3溶液完全反应,则反应后R的化合价为 价;
(5)将32g 铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.请回答:
①待产生的气体全部释放后,向溶液加入V mL amol•L﹣1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L.(用含V、a的式子表示)
②欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%H202的质量为 g。
[化学——选修有机化学基础]在有机化学中有一种“吉利分子”C8H8O8,“吉利分子”C8H8O8可由图中合成。
已知:①相同条件下,X与H2的相对密度之比为81,其中氧的质量分数约为49.4%,分子中氢氧原子个数比为2∶1,X中没有支链;
②1 mol X在稀硫酸中发生反应生成2 mol甲醇和1 mol A;
③A中含有手性碳原子;
④D能使Br2的CCl4溶液褪色,E为高分子化合物,B为环状结构。
根据上述信息填空:
(1)X的分子式为________,A的分子中含有官能团的名称是______,E的结构简式为________;D若为纯净物,D的核磁共振氢谱存在 种吸收峰,面积比为________;
(2)写出下列反应的化学方程式:
反应②__________________,反应类型:________;
反应④__________________,反应类型:________;
(3)写出B的一种含一个六元环的同分异构体的结构简式:________;
(4)一定量的A物质与乙醇的混合物完全燃烧生成18 g水和V L CO2(标准状况),则该混合物完全燃烧消耗氧气的物质的量为________。
[化学——选修物质结构与性质]碳元素在生产生活中具有非常重要的作用,在新物质的制备中也发挥了举足轻重的作用。碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图: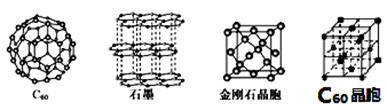
(1)与碳同周期,且基态原子的核外未成对电子数与碳相等的元素,其基态原子的电子排布式为______。
(2)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为____________。
(3)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为________、________。常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是______________。
(4)C60属于________晶体,C60晶体内含有的微粒间作用有_________________。
(5)金刚石晶胞含有________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=__________a,列式表示碳原子在晶胞中的空间占有率________(不要求计算结果)。
某溶液仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 |
K+Ag+Mg2+Cu2+Al3+NH4+ |
| 阴离子 |
Cl-CO32- NO3- SO42-I- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是________________。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是________________。
(3)甲同学最终确定原溶液中所含阳离子有_______,阴离子有______;并据此推测原溶液应该呈______性,原因是________________(用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为__________。充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为________g。
将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到12.6g白色沉淀,向所得的浊液中逐滴加入3mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示: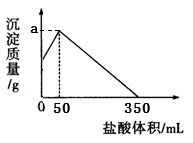
根据题意回答下列问题:
(1)写出将NaOH、AlCl3、MgCl2溶于水时发生反应的离子方程式: ___________
(2)a的值为__________
(3)求出原混合物各成分的物质的量(要求写出计算过程)
(1)近年来,我国用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
C+ K2Cr2O7+ — CO2↑+ K2SO4 + Cr2(SO4)3+ H2O
①完成并配平上述化学方程式。
②在上述方程式上用单线桥标出该反应电子转移的方向与数目。
(2)高温时,用CO还原MgSO4可制备高纯MgO。750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是 。
(3)向FeCl2和FeCl3混合溶液中加入适量KOH,高速搅拌下加入油脂,过滤后干燥得到一类特殊的磁流体材料,其化学式通式为KxFeO2(其组成可理解为aK2O·bFeO·cFe2O3)。
①若x的平均值为1.3,a:b:c=_____________
②若x为1.4,请写出该磁流体在稀硫酸条件下与足量的KI溶液反应的化学方程式:_________。
(4)Fe3O4溶于稀HNO3的离子方程式:_____________。