哈伯因发明了氮气和氢气合成氨气的方法而获得1918年的诺贝尔化学奖,
N2(g)+3H2(g)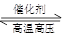 2NH3(g) △H<0。下图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:
2NH3(g) △H<0。下图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:
(1)此反应在50~60s时化学平衡常数为K1 = (列出计算式不用试算)。
(2)反应进行到60s时,改变的条件可能是 。
| A.加入催化剂 | B.扩大容器的体积 |
| C.升高温度 | D.减小氨气的浓度 |
在该条件下,氮气的化学反应速率 。(填“变小”、“变大”或“不变”)
(3)该反应在80s后化学平衡常数为K2,则K1 K2(填“>”、“<”或“=”),此时氮气的转化率为 。
(4)若在110s后向该平衡体系中再加入1mol氨气,则再次达平衡后,氨气在平衡体系中的体积分数 。(填“变小”、“变大”或“不变”)
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图: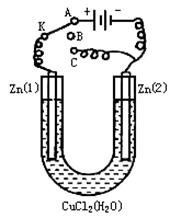
(1)如果把电键K接A,这一装置形成_________装置,Zn①极是________极,其电极反应式是_____ _ __;Zn②极上的电极反应式是____________________。
(2)上述反应进行5min后,转换电键K到C,这一装置形成____________装置,Zn①极是__________极,该装置发生反应的总化学方程式是___________________________;
(8分)物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为_______。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)______________。
(3)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s)  Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
(8分)已知溶液中只存在OH-、H+、Na+、CH3COO-四种离子,试回答下列问题:
(1)若溶液中只溶解了一种溶质,则该溶质是_______,溶液中c(H+)_____c(OH-)(填“>”、“=”或“<”)。
(2)若溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则该溶液中的溶质为_____________,若溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则该溶液中溶质为_________________。
(3)若该溶液是由体积相等的NaOH溶液和醋酸溶液混合而成,且恰好呈中性,则混合前c(NaOH) __________c(CH3COOH),混合前碱中c(OH-)和酸中c(H+)的关系c(OH-)__________c(H+)(填“>”,“=”或“<”)。
氨是重要的氮肥,合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。回答下列问题:在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各种物质的物质的量随时间的变化如图所示,回答下列问题:
2NH3(g) ΔH=-92.4 kJ·mol-1。回答下列问题:在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各种物质的物质的量随时间的变化如图所示,回答下列问题: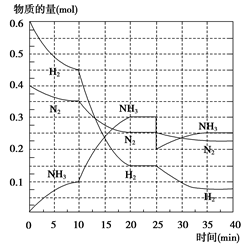
(1)10 min内 以NH3表示的平均反应速率为_________________________
(2)在10~20 min内, NH3浓度变化的原因可能是( )
| A.使用了催化剂 | B.缩小容器体积 |
| C.降低温度 | D.增加NH3物质的量 |
(3)第1次平衡:平衡常数K1= ________________(带数据的表达式),第2次平衡时NH3的体积分数__________;
(4)在反应进行至25 min时,曲线发生变化的原因:______________________达第二次平衡时,新平衡的平衡常数K2______K1(填“大于”、“小于”或“等于”)。
科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2、压强1.0×105 Pa、反应时间3 h):
| T/℃ |
30 |
40 |
50 |
60 |
| NH3生成量/10-6 mol |
4.8 |
5.9 |
6.0 |
6.1 |
相应的热化学方程式:N2(g)+3H2O(l) 2NH3(g)+
2NH3(g)+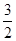 O2(g)ΔH=+765.2 kJ·mol-1
O2(g)ΔH=+765.2 kJ·mol-1
回答下列问题:
(1)请画出上述反应N2(g)+3H2O(l) 2NH3(g)+
2NH3(g)+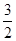 O2(g)ΔH=+765.2 kJ·mol-1
O2(g)ΔH=+765.2 kJ·mol-1
在有催化剂与无催化剂两种情况下反应过程中体系能量变化的示意图,并进行必要标注。
(2)与目前广泛使用的工业合成氨方法相比,该方法固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议:___________________________。
(3)工业合成氨的反应为N2(g)+3H2(g)  2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数为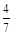 。
。
①该条件下N2的平衡转化率为___________
②该条件下反应2NH3(g)  N2(g)+3H2(g)的平衡常数为_____________
N2(g)+3H2(g)的平衡常数为_____________