榴石矿石可以看作CaO、Fe2O3、Al2O3、SiO2组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下:
(1)榴石矿加盐酸溶解后,溶液里除了Ca2+外,还含有的金属离子是________。
(2)对溶液Ⅰ进行操作时,控制溶液pH=9~10 (有关氢氧化物沉淀的pH见下表)NaOH不能过量,若NaOH过量可能会导致_________溶解, 沉淀。
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Ca(OH)2 |
| 开始沉淀pH |
1.5 |
3.3 |
12.0 |
(3)写出向沉淀物A中加入过量氢氧化钠溶液的离子方程式 。
(4)①某同学在实验室中用图1装置制取CO2气体并通入溶液Ⅱ中,结果没有沉淀产生,可能的原是 ;为了能产生沉淀,该同学对图1装置进行了改进,改进的方法为 。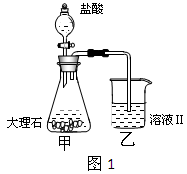
②若将二氧化碳气体通入澄清石灰水中,石灰水变浑浊,混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系 。
已知有以下物质相互转化: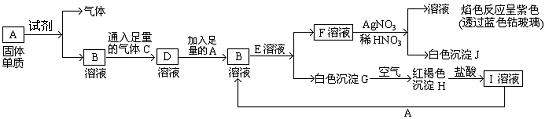
(1)A转化为B及气体这步反应中应加入的试剂是(填化学式);
(2)写出B的化学式,F的化学式;
(3)写出由G转变成H的化学方程式;
(4)写出检验I溶液中阳离子的离子方程式;
向I溶液中加入A的有关离子反应方程式是。
欲用98%的浓硫酸(p=1.84g·cm-3 )配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1)选用的主要仪器有:
①__________,②__________,③__________,④____________,⑤____________。
(2)请将下列各操作,按正确的序号填在横线上。
| A.用量筒量取浓H2SO4 |
| B.反复颠倒摇匀 |
| C.用胶头滴管加蒸馏水至刻度线 |
| D.洗净所用仪器 |
E.稀释浓H2SO4
F.将溶液转入容量瓶
其操作正确的顺序依次为____________________________。
(3)简要回答下列问题:
①所需浓硫酸的体积为____________mL。
②如果实验室有15mL、20mL、50mL的量筒应选用____________mL的量筒最好.
(4)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了_________________________。
(5)在配制过程中,①某学生观察定容时仰视液面,所配溶液的浓度会________(填“偏高”、“偏低”或“无影响”下同)。②未经冷却趁热将溶液注入容量瓶中,________。③摇匀后发现液面低于刻度线再加水,________。④容量瓶中原有少量蒸馏水,________。
怎样用化学方法除去下列物质中混有的少量杂质(用有关反应的离子方程式)。
(1)铜粉中混有铁粉
(2)NaHCO3溶液中混有Na2CO3
(3)FeCl2溶液中混有CuCl2
在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g) 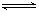 2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: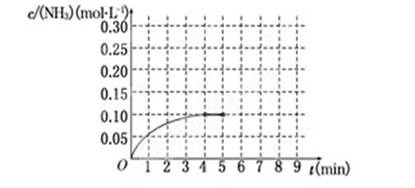
(1)根据上图,计算从反应开始到平衡时,平衡反应速率v(NH3)为__________.
(2)该反应达到平衡时H2的转化率为________.
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为________.(填序号)
a.0.20 mol·L-1b.0.12 mol·L-1
c.0.10 mol·L-1d.0.08 mol·L-1
(4)请写出该反应的平衡常数表达式_________,若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1K2(填“>”“="”" 或 “<” )。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
已知水在25℃和95℃时,其电离平衡曲线如图所示:
(1)则25℃时水的电离平衡曲线应为__________(填“A”或“B”),请说明理由。
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为__________________。
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是____________。
曲线B对应温度下,pH=2的HCl溶液和pH=10的某BOH溶液等体积混合后,混合溶液的pH=8。请分析其原因:。