21世纪的新领域纳米技术正日益受到各国科学家的关注,2000年美国总统克林顿宣布了国家纳米倡议,并于2001年财政年度增加科技支出的26亿美元中,其中5亿给纳米技术。
请根据图回答下列问题: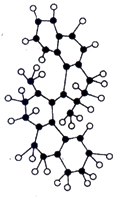
(1)纳米是 单位,1纳米等于 米。纳米科学与技术是研究结构尺寸在1至100纳米范围内材料的性质与应用。它与 分散系的粒子大小一样。
(2)世界上最小的马达,只有千万分之一个蚊子那么大,如图,这种分子马达将来可用于消除体内垃圾。
①该图是马达分子的 (填“比例模型”或“球棍模型”)。
②该分子中含有的组成环的原子是 元素的原子,分子中共有 个该原子。
8.5 g NH3的物质的量是________mol,含有__________个氨分子,_________个原子,标准状况下占有的体积是___________L。
(1)CCl4和蒸馏水都是无色液体,请按下列要求用实验方法鉴别之(简要地写出实验过程)
① 只允许用一种试剂________________
② 不用任何试剂________________
(2)NaCl溶液中含有少量的CaCl2,某学生用过量的Na2CO3使Ca2+离子转化为沉淀而除去,确认Na2CO3已过量的实验方法是________________
金属铜能被氯化铁浓溶液腐蚀,其化学反应是:Cu+2FeCl3=CuCl2+2FeCl2。现将有铜的印刷线路板浸入120mL氯化铁浓溶液中,有9.6g铜被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶解的物质。(设溶液体积不变,且不考虑金属离子水解)。请回答下列问题:
(1)向溶液中加入铁粉后,发生反应的离子反应方程式为 , 。
(2)充分反应后,溶液中存在4.8g不溶物的成分为 。
(3)充分反应后溶液中一定不存在的金属离子为 。
(4)比较Fe2+、Fe3+、Cu2+的氧化性大小: 。
(5)试计算最后溶液中Fe2+离子的物质的量浓度 mol/L
氯气的制取按照传统的方法,一般采用浓盐酸与MnO2共热来制备氯气,但是这种方法制过程中存在缺陷。某学习小组采用新的方法来制备氯气并进行性质实验。
Ⅰ.实验仪器及药品:
a.实验仪器:玻璃片、表面皿(顶部贴有湿润的蓝色石蕊试纸和干燥的石蕊试纸)、胶头滴管等
b.实验药品:KMnO4晶体、浓HCl、KBr溶液、淀粉溶液、KI溶液、FeSO4溶液、NaOH溶液、酚酞、KSCN溶液、AgNO3溶液、湿润的蓝色石蕊试纸和干燥的石蕊试纸。
Ⅱ.实验方法及图示:
①在玻璃片上分别滴加KBr溶液、FeSO4溶液、NaOH稀溶液、KI溶液、AgNO3溶液。
②在KI溶液中滴加一滴淀粉溶液
③FeSO4溶液中滴加一滴KSCN溶液
④NaOH稀溶液中滴加一滴酚酞溶液
⑤在以上溶液分布的中心放置一块KMnO4晶体,然后滴加2-3滴浓盐酸,迅速盖上表面皿。并观察实验现象。
(1)该反应实验原理:2KMnO4+ 16HCl ="2KCl" +2MnCl2 +5Cl2↑+ 8H2O
该反应中氧化剂与还原剂的物质的量之比为 ;
(2)实验时反应一段时间后可以观察到KBr溶液由无色变为 色,其离子反应方程式为 ;
(3)滴有KSCN溶液的FeSO4溶液呈 色,其离子反应方程式为 、 ;
(4)滴加淀粉溶液的KI溶液呈 色,湿润的蓝色石蕊试纸的变化为 ,干燥的石蕊试纸的变化为 。
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)上述冶炼过程中产生大量SO2。下列处理方案合理的是 (填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3d.用浓硫酸吸收
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、Al2O3及不溶于强酸的SiO2)可制备Fe2O3。
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得。
据以上信息回答下列问题:
a.除去Al3+的离子方程式是 。
b.步骤②中滤液氧化的目的是 。
c.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液碘水
所选试剂为 。
证明炉渣中含有FeO的实验现象为 。