已知硝酸铜溶液呈蓝色。但在铜与浓硝酸、稀硝酸反应的实验中,同学们发现,除了生成的气体颜色不相同外,最终溶液的颜色也不相同:前者呈绿色,而后者呈蓝色。甲、乙二位同学为此进行了实验探究。
甲:在I、II两支试管中分别加入等体积的浓HNO3和稀HNO3,再向两支试管中分别投入等质量的铜片,充分反应后铜均无剩余。结果:I中溶液呈绿色,II中溶液呈蓝色。
乙:分别取I中的绿色溶液于两支试管Ⅲ、IV中,对试管Ⅲ进行多次振荡、静置,最终溶液颜色由绿色转变为深蓝色;向试管IV中缓缓加水并不停振荡,观察到溶液由绿色变为深蓝色,最后变为淡蓝色。
请回答下列问题:
(1)分别写出Cu与浓HNO3、稀HNO3反应的化学方程式:__________、__________。
(2)甲的实验_______(“能”或“不能”)说明溶液呈现不同的颜色与其物质的量浓度无关,这是因为充分反应后,I、II两试管中Cu(NO3)2溶液的物质的量浓度_______(填“相等”或“不相等”)。
(3)请你根据乙的实验,推测Cu与浓HNO3反应后溶液呈绿色的原因是________
_______________________________________________________________。
(4)请设计一个方案,验证你所得到的上述结论:____________________________
____________________________________________________________________。
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算。
(1)该小组设计了如图所示的实验装置,关闭分液漏斗活塞,向右侧球形干燥管中加入水,这样操作的目的是_________________。
(2)图中橡胶管的作用是什么?________________。
(3)若在烧瓶中放入1.30 g锌粒,与c mol·L-1 H2SO4反应,为保证实验结论可靠,量气管的适宜规格是________(填字母)。
| A.100 mL | B.200 mL | C.400 mL | D.500 mL |
(4)若1.30 g锌粒完全溶解,氢氧化钠洗气瓶增重0.64 g(烧瓶中残留气体忽略不计,下同),则圆底烧瓶中发生反应的化学方程式为_________________________________________。
(5)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g,量气管中收集到V mL气体(标准状况),请用一个代数式表示出a、b、V之间的关系________________。
(6)若撤走盛有无水氯化钙的U形管,则n(H2)/n(SO2)的数值将________(填“偏大”、“偏小”或“无影响”)。
(7)反应结束后,为了准确地测量气体体积,读数时应注意的事项是(至少写2项):
__________________________________________________________________________。
l,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189.cm ,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可用下列反应制备1,2二溴乙烷。某化学兴趣小组用如图所示的装置(部分固定和夹持装置省略)进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色。
,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可用下列反应制备1,2二溴乙烷。某化学兴趣小组用如图所示的装置(部分固定和夹持装置省略)进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色。
回答下列问题:
(1)写出该实验中产生SO2的化学方程式___________________________________________________。
(2)甲同学认为:溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由是________(填正确答案的标号,下同)。
A.乙烯与溴水易发生取代反应
B.使溴水褪色的物质,未必是乙烯
C.使溴水褪色的反应,未必是加成反应
(3)乙同学经过仔细观察后认为试管中另一现象可证明反应中有乙烯生成,该现象是.
(4)丙同学对上述实验进行了改进,在I和II之间增加如图所示的装置,则A中的试剂为_______,其作用是_______ ,B中的试剂为_______,其作用是_______。
(5)丁同学通过洗涤、蒸馏等操作对l,2一二溴乙烷粗产品进行了精制。该洗涤操作用到的主要玻璃仪器是,该仪器在使用前须清洗干净并。
(14分)下图是某实验小组探究FeSO4固体分解的实验装置。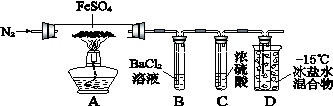
| 实验过程 |
实验现象 |
|
| ① |
通入一段时间N2,加热 |
A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| ② |
用带有火星的木条靠近装置D的导管口 |
木条复燃 |
| ③ |
充分反应,停止加热,冷却后,取A中固体,加盐酸 |
固体溶解,溶液呈黄色 |
| ④ |
将③所得溶液滴入D试管中 |
溶液变为浅绿色 |
已知:SO2熔点–72℃,沸点–10℃;SO3熔点16.8℃,沸点44.8℃。
(1)加热前通入一段时间N2目的是__________________________________。
(2)实验③反应的离子方程式是__________________________________。
(3)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有______气体,依据是_________________________________。
(4)实验④反应的离子方程式是___________________________________________。
(5)某同学依据B中的现象,认为FeSO4分解一定有SO3生成。你认为是否正确,原因是(用必要的文字和化学方程式解释)__________________________________。
(6)有人认为省略B装置同样可以检验是否有产物SO3,若你认为正确,理由是(若你认为不正确,此问不答。)___________________________________________。
(15分)氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。(已知:AlN+NaOH+H2O=NaAlO2+NH3↑)
【方案l】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
(1)左装置图中球形干燥管的作用是。
(2)完成以下实验步骤:组装好实验装置,首先,再加入实验药品。接下来的实验操作是:关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。然后打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是。
(3)由于装置存在缺陷,导致测定结果偏高。请提出改进意见。
【方案2】用右上装置图测定mg样品中AlN的纯度(部分夹持装置已略去)。
(4)为测定生成气体的体积,量气装置中的X液体可以是。
a.CCl4 b.H2O c.NH4Cl溶液 d.
(5)若m g样品完全反应,测得生成气体的体积为VmL(已转换为标准状况)。则AlN的质量分数是。
【方案3】按下图步骤测定样品中AlN的纯度:
(6)AlN的质量分数计算的表达式是。
(7)若在步骤③中未洗涤,测定结果将(填“偏高”、“偏低”或“无影响”)。
某校化学兴趣小组的学生应用下图所示的方法研究氯气的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气。回答下列问题:
(1)上图中,浓H2SO4的作用是_____
(2)实验中,B试剂瓶的实验现象是,C试剂瓶的实验现象是____________,导致C中出现相应现象的物质是(填化学式)。
(3)为了对尾气进行处理,最后的烧杯中应当加入溶液,反应的离子方程式为。