原子内各种关系
(1)原子序数= = =
(2)质量数(A)= +
(3)阳离子:核外电子数= 核电荷数-
(4)阴离子;核外电子数= 核电荷数+
氨在人类的生产和生活中有着广泛的应用
(1)下列含氮物质属于盐的是属于非电解质的是。
| A.NH3 |
| B.NH3•H2O |
| C.NH4NO3 |
| D.HNO3 |
E.N2
(2)0.1 mol的N2H4气体和0.2molNH3气体,它们在同温、同压下的体积比是,所含的原子数比是。
(3)氨气溶解于水,得到的溶液称为氨水。氨溶解于水时与水发生反应生成一水合氨(NH3·H2O),它是一种弱碱。写出一水合氨的电离方程式。从上述电离方程式可知,往氨水中加入稀硫酸生成的盐是(填化学式)
(4)标准状况下,将 2.24L的氨气溶于水配成 0.5L溶液,所得溶液的物质的量浓度为mol/L。
(5)氨可与Cl2反应,反应方程式如下:8NH3+3Cl2=6NH4Cl+N2,利用该反应的原理,在工业上可用于检验输送氯气的管道是否漏气。该反应中,__________是还原剂;若反应中有1.5mol氧化剂参与反应,则发生转移的电子的物质的量为____________mol,被氧化的物质有mol。
(1)氢气被看做是理想的“绿色能源”。用高压氢气、氧气制作氢氧燃料电池是利用氢能的一种重要方式。请写出氢氧燃料电池(电解质溶液为KOH溶液)的电极反应式。
正极;
负极。
(2)电解原理在化学工业中有广泛应用。下图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: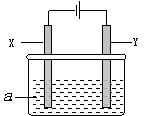
①Y的电极名称是(填写“阳极”或“阴极”)。
②若X、Y都是惰性电极,a是饱和食盐水,实验开始时,同时在两边各滴入几滴酚酞试液,一段时间后,在X极附近观察到的现象是,如何检验Y极上的产物:。(试剂及现象)
(3)若X、Y都是惰性电极,a是CuSO4溶液,电解一段时间后,阳极上产生气体的体积为4.48L(标 准状况下),则阴极上析出金属的质量为g。
(4)若要用该装置电解精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是,Y电极的材料是。
(5)若要用电镀方法在铁表面镀一层金属银,应该选择的方案是。
| 方案 |
X |
Y |
a溶液 |
| A |
铁 |
银 |
AgNO3 |
| B |
铁 |
银 |
Fe(NO3)3 |
| C |
银 |
铁 |
AgNO3 |
| D |
银 |
石墨 |
AgNO3 |
下列是构成原电池的实验方案, 请按要求回答下列问题:
(1)电解质溶液为0.5mol·L-1硫酸溶液,电极为用砂纸打磨过的镁片和铝片,设计成原电池,则铝片为
极(填“正”或“负”),正极电极反应式为;若将电解质溶液改为0.5mol·L-1氢氧化钠溶液,则被氧化的是(填“镁片”或“铝片”),该原电池总反应的离子方程式为:
(2)以“Fe+2Fe3+===3Fe2+ ”反应为原理设计原电池,请在以下该原电池装置图括号中写出电极材料及电解质溶液。
(1)已知:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1;
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ΔH2,则ΔH1ΔH2
(2)在298K、100kPa时,已知:
2H2(g)+O2(g)==2H2O(g) ΔH1
2HCl(g)==Cl2(g)+H2(g)ΔH2
4HCl(g)+O2(g)==2Cl2(g)+2H2O(g)ΔH3
则ΔH3与ΔH1和ΔH2的关系是:ΔH3=
(3)消除氮氧化物的污染对环境至关重要,用CH4催化还原NOx可以消除氮氧化物的污染。已知一定条件下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
则该条件下,用CH4还原NO2至N2的热化学方程式为:
(4)乙烯是石油裂解气的主要成分之一, 25℃、101kPa时,1g乙烯燃烧生成CO2气体与液态水,放出50.5 kJ的热量,该反应的热化学方程式为 __;利用该反应设计为燃料电池中,通入乙烯的电极为电池的________(填“正极”或“负极”)。
硫酸生产中,SO2催化氧化生成SO3:2SO2 (g)+O2(g)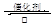 2SO3(g) ΔH= —196.6Kj/mol
2SO3(g) ΔH= —196.6Kj/mol
(1)t1℃时,若将2.0mol SO2和1.0mol O2置于10L恒温恒容密闭容器中,8min后反应达到平衡,SO2的平衡转化率为80%,则这段时间内SO3的平均反应速率为,该温度下上述反应的平衡常数K为
(2)该反应达到化学平衡后,以下操作将使平衡正向移动并能提高SO2转化率的是
A.向容器中通入少量O2
B.向容器中通入少量SO2
C.使用催化剂
D.降低温度
E.向容器中通入少量氦气
(3)下列叙述能证明该反应已达到化学平衡状态的是
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2n molSO2的同时生成2n molSO3
E.反应体系中SO2、O2、SO3的体积比为2:1:2