下图所示各步变化,A为金属,B为淡黄色固体粉末,每一物质均含有A元素。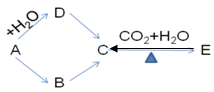
(1) 写出下列物质的化学式:B C D E
(2) 写出下列步骤的化学反应方程式
A→B:
B→C:
(3) 写出下列步骤的离子反应方程式
A→D:
照相底片的感光材料上含有一层AgBr胶体粒子的明胶,照相感光过程中,在光的作用下,AgBr分解成“银核”AgBr→Ag+Br显影时,感光材料经过显影液作用,含有银核的AgBr粒子被还原为金属银,成为黑色成像,而大量未感光的AgBr粒子在定影时,与定影液中的硫代硫酸钠(Na2S2O3)反应形成 [Ag(S2O3)2]3-络离子而溶解于定影液中:
Ag++2S2O32-=[Ag(S2O3)2]3-
本实验采用简单的化学沉淀方法从废定影液中回收银的方法。其原理是在废定影液中加入硫化钠与定影液中的络离子中的银转化为Ag2S沉淀,并使定影液再生,;再将硫化银送至高温炉灼烧,硫化银就分解为单质银和二氧化硫气体,就达到回收银的目的。
(1)写出Na2S与Na3[Ag(S2O3)2]反应的化学方程式
(2)如果废定影液中含银量为5.68g.L-1试计算2升废定影液中至少加入Na2S的物质的量是。(保留小数点后四位数)
12分)
氟、氯、溴3种元素同属于周期表中第VIIA族。
(1)3种元素中电负性最小的基态原子的价电子排布式是。
(2)氢氟酸是弱酸的原因是。
(3)氯元素可广泛存在于无机物和有机物中。二氯甲烷(CH2Cl2)是甲烷分子中碳原子上连接的两个氢原子被两个氯原子取代形成的一种氯代物,其分子中碳原子轨道的杂化类型是____,氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是分子。(“极性”或“非极性”)
(4)冰晶石(Na3AlF6)主要用作电解Al2O3生产铝的助熔剂,其晶体不导电,但熔融时能导电。在冰晶石(Na3AlF6)晶体中存在(填选项)。
| A.离子键 | B.极性键 | C.配位键 | D.范德华力 |
(5)氰[(CN)2]是一种分子构型和化学性质与卤素单质很相似的化合物,称为拟卤素。一个氰分子中含有____个π键。
(10分 )Ⅰ.1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
⑴.科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 |
NaCl |
KCl |
CaO |
| 晶格能/(kJ·mol-1) |
786 |
715 |
3 401 |
4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是 。
⑵.科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.
①写出基态Cu原子的核外电子排布式
②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)
Ⅱ.常见有机化合物,如①CH2=CH2、②CH≡CH、③ 等,其中碳原子采取sp2杂化的分子有(填物质序号),HCHO分子中心原子C也是采取sp2杂化成键,预测HCHO分子的立体结构为形。
等,其中碳原子采取sp2杂化的分子有(填物质序号),HCHO分子中心原子C也是采取sp2杂化成键,预测HCHO分子的立体结构为形。
.铜及其合金是人类最早使用的金属材料。
⑴下图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为。
⑵Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有(填序号)。
| A.配位键 | B.金属键 | C.极性共价键 | D.非极性共价键 E.离子键 |
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为。
并画出这两种不同结构的产物的结构简式(体现配位键):
下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。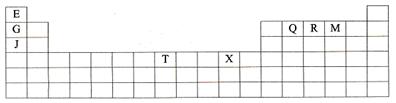
(1)T3+的核外电子排布式是:
(2)Q、R、M的第一电离能由大到小的顺序是(用元素符号表示)
(3)根据下列说法填空:
①G单质的熔点高于J单质,是因为
②将J2M2溶于水,要破坏(离子键、极性共价键、非极性共价键)
③RE3沸点高于QE4,是因为
④一个Q2E4分子中E的轨道与Q的轨道形成σ键。
(4)G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 (填G或R的元素符号)