在一个小烧杯里,加入20gBa(OH)2.H2O粉末,将小烧杯放在事先已滴有3~4滴水的玻璃片上。然后加入10gNH4Cl晶体,并立即用玻璃棒搅拌。
(1)试验中玻璃棒的作用是 。
(2)写出有关反应的方程式 ,该反应属于 反应。
(3)实验中观察到的现象有 , 和反应混合物成糊状。反应混合物呈糊状的原因是 。
(4)通过 现象,说明该反应为 热反应,这是由于反应物的总能量 生成物的总能量。
某化学兴趣探究小组将一批废弃的线路板简单处理后,得到含Cu(70%)、Al(25%)、Fe(4%)及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: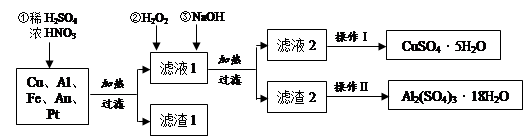
(1)在金属混合物与酸的反应中,表现氧化性的离子为;得到滤渣1的主要成分为。
(2)第②步加H2O2后发生反应的离子方程式为;
通过加入NaOH调节溶液的pH,其目的是;
(3)操作Ⅰ中包括的实验步骤有、过滤;
(4)通过操作Ⅱ可以由滤渣2制取Al2(SO4)3·18H2O 。下列是操作Ⅱ的一种实验方案。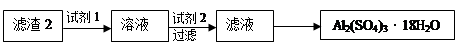
实验中:试剂1是,试剂2是。(填化学式)
Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题:
(1)甲同学取一束细铜丝用砂纸打磨后在酒精灯上加热至红热,再伸到Cl2的集气瓶中。你认为甲同学在实验中应该观察到的现象是__________________________。
(2)乙同学为验证Fe在冷的浓HNO3中发生钝化但能和热的浓HNO3反应,设计了如图所示的实验,请你指出其中的两处错误:____________________________、_________________________;纠正上述错误后,请你从绿色化学的角度出发,对装置2提出改进建议,使装置2既能控制反应的进行,又能减少氮氧化物的排放:__________________________________________.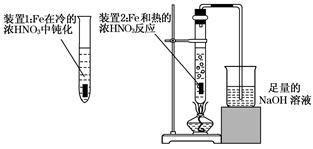
(3)丙同学在Fe和浓HNO3反应后的溶液中加入一块Cu片,Cu片逐渐溶解,反应一段时间后不再溶解(Cu有剩余)。
①丙同学依据反应现象得出Cu片溶解的原因是和HNO3发生反应.他依据的反应现象是___________。
②丁同学认为丙同学的结论不完全正确.他的理由是_________________________.
(4)请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+。说明具体的操作和实验现象_________________________________________。
硫酸是一种实验室常用的化学试剂。请按要求填空:
(1)浓硫酸试剂瓶上适合贴上的图标是(填写字母标号)。
(2)实验室有1.00mol·L-1的硫酸溶液,从中准确量出10.00 mL,其物质的量浓度为mol·L-1。现将准确量出的10.00 mL的硫酸溶液配制成0.100mol·L-1的稀硫酸,所需要的玻璃仪器除烧杯、玻璃棒还需和。
(3)用图所示的实验装置验证铜与浓硫酸反应生成的气体产物,则装置②、③分别为。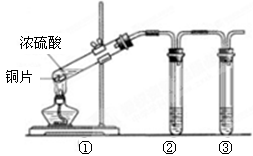
A.品红溶液 B.BaCl2溶液 C.NaOH溶液 D.AgNO3溶液
(4)装置①中发生反应的化学方程式为,
若装置①中加入铜6.4g和含有0.2molH2SO4的浓硫酸,则产生二氧化硫质量
A.等于6.4克 B.大于6.4克 C.小于6.4克 D.不能确定
(5)若将装置①中的铜片换成木炭,装置②试管内为品红溶液, 装置③试管内为澄清石灰水,则装置①中发生反应的化学方程式为。装置②中的现象是。根据装置③观察到有白色沉淀生成的现象 ,(填“能”或“不能”)判断该白色沉淀一定只有CaCO3。
某化学实验小组同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置: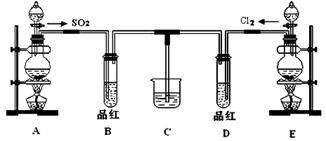
(1)用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是。
(2)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B;D。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:
B;D。
(3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示):。
(4)SO2和Cl2均属于大气污染物,需要进行尾气处理(用装置C),则在装置C中的试剂是_____(填名称),请写出SO2和Cl2分别与该试剂反应的离子方程式, 。
NaHCO3和Na2CO3·xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量)。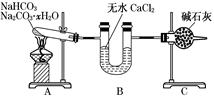
(1)A装置的作用是____________________________。
(2)B装置的作用是____________________________。
(3)C装置的作用是____________________________。
(4)若在装置A的试管中装入NaHCO3和Na2CO3·xH2O的混合物3.7 g,用酒精灯加热到反应完全,此时B管增重1.89 g,C管增重0.22 g,则x的值为。
(5)该装置还不是很完善,可能使测定结果偏小,应如何改进________。为什么?