某铝合金中含有合金元素镁、铜、硅,为了测定该合金中铝的含量,设计了如下实验,请回答有关问题:
(1)称取样品ag,称量时应该使用的主要仪器的名称是 。
(2)将样品溶解于足量的稀盐酸,过滤。滤液中主要含有 ,滤渣中含有 ,溶解、过滤用到的玻璃仪器是 ,如果这一实验在月球上完成,它比在地球上做要 (填“容易”或“难”)。
(3)滤液中加过量的氢氧化钠溶液,过滤,有关反应的离子方程式为 。
(4)向步骤(3)的滤液中通入足量的二氧化碳气体,过滤,有关反应的离子方程式为 。
(5)步骤(4)过滤后的滤渣用蒸馏水洗涤数次,烘干并灼烧至恒重,冷却后称重,其质量为b g,原样品中铝的质量分数是 。
(6)若步骤(3)中加入氢氧化钠的量不足,则实验结果 (填“偏高”、“偏低”或“不影响”,下同);若步骤(5)中滤渣没有洗涤,则实验结果 ,若滤渣灼烧不充分,则实验结果 。
某同学对Cl2与KI溶液的反应进行了实验探究。反应装置如下: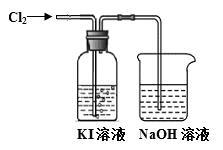
通入氯气一段时间,KI溶液变为黄色。继续通入氯气一段时间后,溶液黄色褪去,变为无色。继续通入氯气,最后溶液变为浅黄绿色。
(1)Cl2与NaOH溶液反应的化学方程式是 。
(2)KI溶液变为黄色说明氯气具有的 性,该反应的离子方程式 。
(3)已知I2+I- I3-,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行以下实验。
I3-,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行以下实验。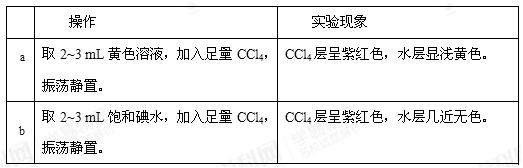
①实验b的目的是 。
②根据实验a中,水层中含有的粒子有 。
③用化学平衡原理解释实验a中水溶液颜色变浅的原因: 。
④为保证实验的严谨性,在实验a、b的基础上,需补充一个实验,该实验为 。
(4)通入氯气,溶液由黄色变为无色,是因为氯气将I2氧化。已知1 mol Cl2可氧化0.2 mol I2,该反应的化学方程式是 。
(5)根据上述实验,请预测向淀粉-KI溶液中持续通入氯气,可能观察到的现象为 。
(6)溶液最终变为浅绿色的原因是 。
某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是 。
(2)已知:
20℃时溶解度/g
| CaCO3 |
CaSO4 |
Mg(OH)2 |
MgCO3 |
| 1.4×10-3 |
2.55×10-2 |
9×10-4 |
1.1×10-2 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程 。
(3)在步骤Ⅱ中:
① 被除掉的水垢除铁锈外,还有 。
② 清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因 。
(4)步骤Ⅲ中,加入Na2SO3的目的是 。
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe2O3保护膜。
① 完成并配平其反应的离子方程式: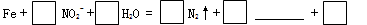
②下面检测钝化效果的方法合理的是 。
a. 在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b. 在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c. 在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
d. 在炉面上滴加浓HNO3,观察出现红棕色气体的时间
为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
实验过程:
I. 打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ. 打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ. 当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ. 打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ. 打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ. 更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是 。
(2)棉花中浸润的溶液为 。
(3)A中发生反应的化学方程式为 。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是 。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性Cl2 > Fe3+ > SO2的是 (填“甲”“乙”“丙”)。
| 过程Ⅳ B溶液中含有的离子 |
过程Ⅵ B溶液中含有的离子 |
|
| 甲 |
有Fe3+无Fe2+ |
有SO42- |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42- |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
(6)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料:Fe2+(aq)+ SO32- (aq) FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。
某同学设计如下实验,证实该假设成立:
①溶液E和F分别为 、 。
②请用化学平衡原理解释步骤3中溶液由红棕色变为浅绿色的原因 。
(14分,每空2分)某中学的化学兴趣小组对SO2与漂白粉的反应进行实验探究,实验过程如下:取10克漂白粉固体,加入250mL水中,部分固体溶解溶液略有颜色,过滤后用洁净的玻璃棒沾取滤液到pH试纸上,发现pH试纸先变蓝(约为12)后褪色.回答下列问题:
(1)工业制取漂白粉的化学方程式是 。漂白粉在空气中变质的原因 (用化学反应方程式说明)。
(2)pH试纸颜色的变化说明漂白粉溶液具有的性质是 ,ClO2和漂白粉一样也具有强氧化性,其消毒效率(以单位物质的量得电子的数目表示)是Cl2的 倍;
(3)将SO2持续通入漂白粉溶液中,发现澄清透明的溶液先变为黄绿色,随后溶液中产生大量白色沉淀且黄绿色褪去。回答下列问题:
①澄清透明溶液变为黄绿色的可能原因是:随溶液酸性的增强,漂白粉的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是 ;
②用离子方程式解释现象中黄绿色褪去的原因: ;
③SO2与漂白粉的有效成分在酸性条件下反应的离子方程式: 。
氮化硅的强度很高,尤其是热压氮化硅,是世界上最坚硬的物质之一,氮化硅陶瓷可做燃气轮机的燃烧室、机械密封环、输送铝液的电磁泵的管道及阀门、永久性模具、钢水分离环等。制备氮化硅可将硅粉放在氮气中加热至1000℃左右直接氮化制得,实验室制备氮化硅装置示意图如下: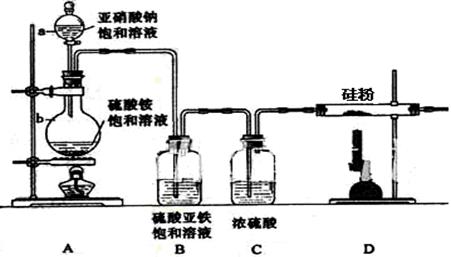
回答下列问题:
(1)检查装置气密性的方法是 ,a仪器的名称是 。
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式 ;
(3)装置B的作用是 ,装置C的作用是 ;
(4)已知氮化硅的化学性质稳定,但常温下易溶于氢氟酸溶液生成一种白色的胶状沉淀和一种盐,请写出此化学反应方程式: ;
(5)实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是()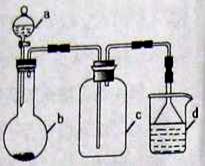
| 选项 |
a物质 |
b物质 |
c收集的气体 |
d中的物质 |
| A |
浓氨水 |
NaOH |
NH3 |
H2O |
| B |
浓硫酸 |
Na2SO3 |
SO2 |
澄清石灰水 |
| C |
稀硝酸 |
Fe |
NO2 |
H2O |
| D |
浓盐酸 |
KMnO4 |
Cl2 |
NaOH溶液 |