从铝土矿(主要成分是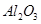 ,含
,含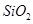 、
、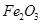 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下: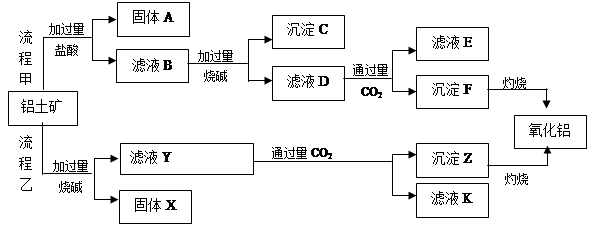

 请回答下列问题:
请回答下列问题: (1)流程乙加入烧碱后的离子方程式为_________________________________________.
(1)流程乙加入烧碱后的离子方程式为_________________________________________. (2)固体A的应用_________________________________________.(两点)
(2)固体A的应用_________________________________________.(两点) (3)
(3) 滤液D与少量CO2反应的离子方程式为__________________________________,
滤液D与少量CO2反应的离子方程式为__________________________________,
向该滤液K中加入足量石灰水的离子方程式是________
(4)流程乙制氧化铝的优点是所用的试剂较经济,缺点是 __________________________
__________________________
(5)已知298K时,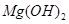 的溶度积常数
的溶度积常数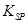 =10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的PH最小为_______.
=10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的PH最小为_______.
以下是元素周期表的示意图,请参照①~⑧在表中的位置,用化学用语回答下列问题:
(1)元素②和⑤的单质和化合物之间在一定条件下存在反应: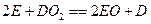 ,其中
,其中 为直线形的非极性分子。
为直线形的非极性分子。 的结构式为_________。
的结构式为_________。
(2)元素③的气态氢化物与最高价氧化物对应的水化物之间可以反应生成盐,该盐在实际生活中的一种用途为___________________________。
(3)元素⑥的单质既能与强酸反应,又能与强碱反应,且元素⑥的单质可以在高温条件下还原三氧化二铁。该反应的化学方程式为___________________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为_________(填一种物质的化学式)。
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生如下反应:
①X溶液与Y溶液反应的离子方程式为___________________________。
② ⑥的单质化学方程式为___________________________。
⑥的单质化学方程式为___________________________。
③常温下,为使 溶液中由
溶液中由 电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至__________________。
电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至__________________。
一切植物中均含有天然有机高分子化合物A,它是构成植物细胞壁的基础物质,不溶于水,也不溶于一般有机溶剂.能发生如下变化(A~F均分别代表一种物质,框图中的部分产物已略去,如:B生成C的同时还有CO2生成.)
(1)由A生成B化学方程式为.
(2)B、D均含有的官能团是,设计实验,用弱氧化剂检验(1)所得到的溶液中
的B分子结构中存在该官能团(要求:所需仪器和药品可以任选,如需采用实验室不
能长期保存的试剂请写出它的制备过程;以下步骤可以不填满.)
①
②
③
④
(3)从A到F发生的反应类型有.
A.氧化 B.酯化 C.消去 D.水解
(4)写出C到D所发生的化学反应的化学方程式.
(5)F有多种同分异构体,请写出与它有相同官能团的所有同分异构体
.
如下图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题.
(1)打开K2,合并K1.B为极,A的电极反应为,最终可观察到的现象是.
(2)打开K1,合并K2.E为极,F极的电极反应为,
检验F极产生气体的方法是.
(3)若往U型管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是,原因是.
A、B、C、D、E、F均为常见的短周期元素,原子序数依次增大,已知:
① A元素中的一种原子没有中子.
② B元素原子最外层电子数是次外层电子数的2倍.
③ C元素最高正价与最低负价的代数和为2.
④ A与D能以原子个数比1:1、2:1形成两种液态化合物.
⑤ E2+离子的电子层结构与氖原子相同.
⑥ F元素有多种化合价,且常温下F元素的单质与强碱溶液反应,可得到两种含F元素
的化合物.
⑦ C、F两种元素质子数之和是B元素质子数的4倍.
回答下列问题:
(1)A元素中没有中子的同位素的原子组成符号为,F简单阴离子的结构示意图,化合物AFD的电子式为,B2A2的结构式为.
(2)由C、F两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里C、F两种原子最外层均达到8个电子的稳定结构.X遇水蒸气可形成一种常见的漂白性物质.则X的分子式;分子中C、F原子间的化学键的类型为(填“极性键”或“非极性键”),属于分子(填“极性”或“非极性”),X与水反应的化学方程式为.
(3)B、C两种元素可形成一种硬度比金刚石还大的化合物Y.在化合物Y中,B、C两原子以单键相结合,且每个原子的最外层均达到8个电子的稳定结构.则Y的化学式为,Y的硬度比金刚石硬度大的原因是.
一切植物中均含有天然有机高分子化合物A,它是构成植物细胞壁的基础物质,不溶于水,也不溶于一般有机溶剂.能发生如下变化(A~F均分别代表一种物质,框图中的部分产物已略去,如:B生成C的同时还有CO2生成.)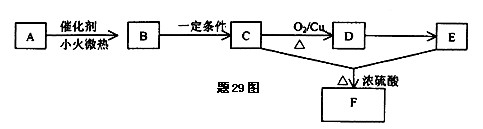
(1)由A生成B化学方程式为.
(2)B、D均含有的官能团是,设计实验,用弱氧化剂检验(1)所得到的溶液中
的B分子结构中存在该官能团(要求:所需仪器和药品可以任选,如需采用实验室不
能长期保存的试剂请写出它的制备过程;以下步骤可以不填满.)
①
②
③
④
(3)从A到F发生的反应类型有.
A.氧化 B.酯化 C.消去 D.水解
(4)写出C到D所发生的化学反应的化学方程式.
(5)F有多种同分异构体,请写出与它有相同官能团的所有同分异构体
.