(1)标准状况下,2.24LCH4、HCHO、C2H6的混合气充分燃烧后,生成CO2 0.14mol,该混合气体中C2H6的体积分数
(2)某气态不饱和烃在标准状况下的密度为2.41g/ L。取0.54 g该烃恰好与浓度为0.2 mol / L的溴水100mL完全反应,使溴水完全褪色。求该烃的分子式及结构简式
.(1)利用VSEPR推断分子或离子的空间构型。PO;CS2;AlBr3(共价分子)。
(2)有两种活性反应中间体粒子,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种粒子的球棍模型,写出相应的化学式: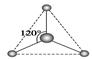 __________;
__________; __________。
__________。
(3)按要求写出第二周期非金属元素构成的中性分子的化学式。
平面三角形分子________,三角锥形分子________,四面体形分子________。
在一固定容积的密闭容器中,保持一定条件下进行以下反应:X(g)+2Y(g) 3Z(g),已知加入1 molX和3molY。达到平衡后,生成a mol Z。
3Z(g),已知加入1 molX和3molY。达到平衡后,生成a mol Z。
(1)在相同实验条件下,若在同一容器中改为加入2 mol X和6 mol Y,达到平衡后,Z的物质的量为。
(2)在相同实验条件下,若在同一容器中改为加入2 mol X和7 mol Y,若要求在反应混合气体中Z体积分数不变,则还需加入Zmol。
(3)在相同实验条件下,若在同一容器中改为加入0.5molX,则需加入mol Y,mol Z,才能使平衡时Z为0.8a mol。
(8分)两个极易导热的材料做成的体积相等的容器A和B,A是密闭定容的,B带上下可移动的活塞(气体不渗漏).在等温下向A、B两容器中充入等物质的量的N2O4固体并使之迅速气化.
(1)在两容器内N2O4刚刚全部气化的时刻(温度相同),两容器中出现的现象是___________________________________________.
(2)反应进行的某时刻t1(s)时,两容器生成NO2的速率AB(大于、小于、等于),理由是.
(3)当两容器内都达到平衡时,N2O4的转化率AB(大于、小于、等于),理由是.
在一个固定体积的密闭容器中,向容器中充入2 mol A和1 mol B,发生如下反应:2A(g) + B(g)  3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L。
3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L。
(1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为________(填“吸热”或“放热”)反应。
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是_________(用序号填空)
①4 mol A+2 mol B ②3mol C+1 mol D+l mol B
③3 mol C+2 mol D ④1.6 mol A+0.8 mol B+0.6 mol C
⑤2 mol A+1mol B+1 molHe
(3)某温度下,向容器中加入3 mol C和0.8 mo1 D,反应达到平衡时C的浓度仍为1.2 mol/L,则容器的容积V应大于_________L,小于________L。
(8分)在一定温度下,有a. 醋酸 b.硫酸 c.盐酸三种酸:
(1)当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是
用a、b、c表示,下同)
(2) 当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为.反应所需时间的长短关系是______________________.
(3)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是______________________.